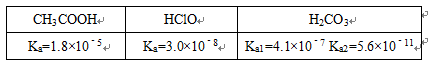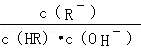- 电解质溶液的导电性
- 共60题
11.某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是
正确答案
解析
在乙图装置中,Cu易失电子作负极、Cu作负极,当电流计中指针发生偏转时,盐桥中钾离子向正极移动,所以盐桥中的SO42-流向乙烧杯移动,Cu作负极,负极上Cu失电子发生氧化反应,电极反应式为Cu -2e-= Cu 2+,Pt为正极,正极上铁离子得电子发生还原反应,电极反应为Fe3++e-= Fe2+,甲烧杯中溶液的血红色逐渐变浅。若将甲烧杯中的溶液换成稀硝酸,稀硝酸属于强氧化剂其氧化性强于Fe3+,电流表指针依然是Pt为正极,Cu作负极。
考查方向
解题思路
原电池中,电子由负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动;根据失电子难易程度确定正负极,再结合电解质溶液中离子移动方向分析解答,难点是电极反应式书写
易错点
根据失电子难易程度确定正负极。
知识点
9.铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
①浸取反应中氧化剂的化学式为_______;滤渣Ⅰ的成分为MnO2、S和_______(写化学式)
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过_______mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式______________。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是_______(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则导线中通过了_______mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差_______g
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH_______ (填“减小”、“增大”或“不变”) ,乙池中石墨为_______极(填“正”、“负”、“阴”或“阳”)
正确答案
(1)①MnO2 SiO2;
②2.2
③Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+;
④(NH4)2SO4
(2)①0.1;7.05
②增大;阴
解析
①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,所以根据方程式判断出浸取反应中氧化剂的为MnO2;根据物质的性质可以知道过滤得到滤渣为MnO2、SiO2、单质S,所以答案为:MnO2、SiO2;
②根据pH为4可以知道c(OH-)=10-10mol/L,再根据Ksp[Cu(OH)2]知道c(Cu2+)=Ksp/[c(OH-)2]=2.2mol/L;所以答案为2.2
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,所以该反应的离子方程式为:Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+;故答案为:Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+
④ 根据元素守恒判断滤液Ⅱ盐的主要成分。滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,故答案为:(NH4)2SO4 。
(2)①设导线中通过的电子的物质的量为x,则负极减少28 g·mol-1·x,正极增重32 g·mol-1·x,28x+32x=6,x=0.1mol。若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,根据盐桥的作用,甲池由于电极反应增加质量为2.8g,移动到甲池的Cl-也为0.1mol,质量增加3.55g,所以甲池总共增加(2.8+3.55)=6.35g,而乙池由于电极反应质量减少3.2g,移动到乙池的K+也为0.1mol,质量增加3.9g,所以乙池总共增加(3.9-3.2)=0.7g,所以乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差6.35+0.7 =7.05g。故答案为:0.1;7.05。
②乙池石墨棒析出了紫红色固体,则甲池为原电池,乙池为电解池,甲池中铜电极为正极,发生吸氧腐蚀反应,所以生成OH-,乙池中石墨电极为阴极;故答案为:增大;阴。
考查方向
解题思路
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜。
①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;
②根据Ksp[Cu(OH)2]进行计算;
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;
④ 根据元素守恒判断滤液Ⅱ盐的主要成分。滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体.
(2)①根据导线中通过的电子的物质的量与两个电极质量变化的关系求解;
②乙池石墨棒析出了紫红色固体,则甲池为原电池,乙池为电解池,甲池中铜电极为正极,发生吸氧腐蚀反应,所以生成OH-,乙池中石墨电极为阴极;
易错点
不能有效提取图表中信息,阅读材料、接受信息的能力不强,物质的分离提纯的方法掌握不熟练,不能通过化合价变化确立氧化剂,不能根据Ksp[Cu(OH)2]进行有关计算,不能根据原子守恒确立断滤液的主要成分,没有理解盐桥的作用。
知识点
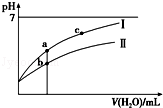
11.已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、 HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是
正确答案
解析
根据表中电离常数可知:酸性由强至弱的顺序为CH 3 COOH>H 2 CO 3 >HClO>HCO,结合质子的能力由大到小的顺序为>ClO- >>CH 3 COO- 。
A项, ClO- 的水解程度大于CH 3 COO- 的水解程度,同浓度CH 3 COONa和NaClO的混合液中,各离子浓度的大小关系应是 c (Na+ )> c (CH 3 COO- )> c (ClO- )> c (OH- )> c (H+ ),错误;
B项, 结合质子的能力大于ClO- 结合质子的能力,离子方程式应为ClO- +CO 2 +H 2 O=HClO+,错误;
C项, 分子、分母同乘以溶液中 c (H+ ),得,该式即为 K 电离 / K w ,温度相同则该式的值相等,正确;
D项, CH 3 COOH的酸性强于HClO,pH相同时,HClO的浓度大于CH 3 COOH的浓度,错误。
考查方向
解题思路
由表格可知,酸性的强弱顺序为CH3COOH >H2CO3> HClO>HCO3-,大于A中相同浓度CH3COONa和NaClO的混合液中,由于醋酸酸性强于次氯酸,则NaClO的水解程度CH3COONa,则溶液中c(CH3COO﹣) >c(ClO﹣),;B、由于酸性H2CO3> HClO>HCO3-,则向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O═HClO+HCO3﹣;C、由图象可知,稀释过程中,Ⅰ的变化程度更大,则Ⅰ为酸性更强的CH3COOH,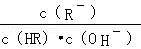
易错点
1、溶液导电能力大小与溶液中自由移动离子成正比,与电解质强弱无关,为易错点。
2、弱电解质的电离要根据酸的电离常数与酸根离子水解程度、酸的酸性强弱等知识点来分析解答。
知识点
11.一种熔融碳酸盐燃料电池工作原理如图所示。则下列推断错误的是( )
正确答案
解析
A.负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32﹣﹣4e﹣=H2O+3CO2,有二氧化碳生成,故A正确;
B.正极为氧气得电子生成CO32﹣,反应为O2+2CO2+4e﹣=2CO32﹣,故B正确;
C.反应CH4+H2O
D.熔融碳酸盐为电解质,应在高温下进行工作,常温下不能形成原电池,故D错误。故选D。
考查方向
解题思路
甲烷和水经催化重整生成CO和H2,反应中C元素化合价由﹣4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32﹣,以此解答该题。
易错点
化学电源新型电池,易错点点在明确原电池中物质得失电子、电子流向、离子流向,难点是电极反应式书写,要根据电解质确定正负极产物。
知识点
9.如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是
正确答案
解析
A、甲池中为原电池反应,对应的电极反应式是:正极O2+4e-+2H2O=4OH-,负极N2H4-4e-+4OH-=N2+4H2O,故A错误;
B、甲池中因反应生成了水会使溶液的pH值减小,乙池中因反应生成了酸也会使溶液的pH值减小,故B错误;
C、选项中没说明气体的体积是否是标准状况下,所以气体的物质的量无法计算,则乙中生成的固体的质量也无法计算,故C错误;
D、乙池发生的是电解池反应,其电解总反应的离子方程式为:2Cu2++2H2O 通电2Cu+4H++O2↑,两极析出的分别是Cu和O2,因而加CuO后溶液能够复原,故D正确.
故选D.
考查方向
本题主要考查了原电池和电解池的工作原理
解题思路
本题考查了原电池、电解池工作的基本原理,以及原电池电极反应式的书写,注意把握原电池和电解池中电极方程式的书写方法。由图可知,甲为原电池,乙为电解池,甲池的总反应式为:N2H4+O2═N2+2H2O,则通过化合价的变化可知,N2H4的化合价升高,为负极,但电解质溶液为KOH,则电极反应为N2H4﹣4e﹣+4OH-═N2+4H2O,
甲池中生成了水,导致甲池中的PH变小;C中没有指明是否为标准状况下,不能进行计算;乙池中的总反应为2CuSO4+2H2O=2H2SO4+2Cu+O2,加入CuO,可与硫酸发生反应,生成硫酸铜,恢复到原浓度。
易错点
1、原电池和电解池中电极方程式的书写方法。
2、通过化合价的变化判断电极的正负极。
知识点
扫码查看完整答案与解析