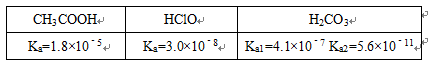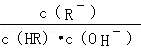- 电解质溶液的导电性
- 共60题
6.常温下,关于pH = 2的盐酸,下列说法不正确的是( )
正确答案
解析
A.常温下,由于溶液的pH = 2,所以溶液中c(H+) = 1.0ⅹ10-2 mol·L-1,所以A正确;
B.常温下,pH=2的盐酸中氢离子浓度为1.0ⅹ10-2mol/L,盐酸溶液中氢氧根离子为水电离的,浓度为1.0×10-12,所以由H2O电离出的c(H+)=1.0×10-12mol•L-1,所以B正确;
C.由于盐酸为强酸,所以加水稀释10n倍后,溶液的pH增加n;所以稀释100倍后,溶液的pH 增加2,pH=4,所以C正确;
D.一水合氨为弱电解质,溶液中部分电离,pH=12的氨水溶液中c(OH-)=1.0ⅹ10-2mol/L,pH=2的盐酸中氢离子浓度c(H+) = 1.0ⅹ10-2 mol·L-1,所以等体积的氨水与盐酸混合,氨水中还有过量的一水合氨,导致溶液显示碱性,所以D错误。
考查方向
强、弱电解质在水溶液中的电离平衡及多水的电离平衡的影响。
解题思路
A.常温下,由于溶液的pH = 2,所以溶液中c(H+) = 1.0ⅹ10-2 mol·L-1;
B.常温下,pH=2的盐酸中氢离子浓度为1.0ⅹ10-2mol/L,盐酸溶液中氢氧根离子为水电离的,浓度为1.0×10-12,所以由H2O电离出的c(H+)=1.0×10-12mol•L-1;
C.由于盐酸为强酸,所以加水稀释10n倍后,溶液的pH增加n;
D.一水合氨为弱电解质,溶液中部分电离,pH=12的氨水溶液中c(OH-)=1.0ⅹ10-2mol/L,pH=2的盐酸中氢离子浓度c(H+) = 1.0ⅹ10-2 mol·L-1,所以等体积的氨水与盐酸混合,氨水中还有过量的一水合氨,导致溶液显示碱性。
易错点
酸溶液中存在两种H+,由水电离的H+和有酸电离的H+,其中水电离的H+浓度一定等于溶液中的OH-。
知识点
5.下列表述不正确的是( )
正确答案
解析
A、原电池中阴离子移向负极,阳离子移向正极,该原电池锌、硫酸锌溶液为负极,则Cl-移向ZnSO4溶液,故A正确;
B、电解池,a与正极相连是阳极,溶液中氯离子失电子生成氯气,2Cl--2e-=Cl2↑,氯气和碘化钾反应生成碘单质,使湿润的淀粉碘化钾试纸变蓝,故B正确;
C、精炼铜,粗铜作阳极,反应为Cu-2e-=Cu2+,故C不正确;
D、吸氧腐蚀,正极反应为O2+4e-+2H2O=4OH-,故D正确;
考查方向
本题主要考查电化学的相关知识。
解题思路
C项铜的电解精炼,粗铜为阳极,电极反应式为: Cu-2e-=Cu2+。
易错点
不能掌握原电池和电解池的工作原理。
知识点
4.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
正确答案
解析
A、糖类物质组成是由C、H、O三种元素组成,单不能简单为认为是碳水化合物,例如甲醛
B、从图形中得知MnO2变成Mn2+发生了化合价降低过程中,因此左边为正极反应,该燃料电池应用了MnO2做氧化剂。C、在电池内部正电荷向正极移动。D、当电路中需要转移6NA电子时,需要消耗的葡萄糖为45g
考查方向
本题考查电化学内容,主要考察了学生对燃料电池的理解应用以及氧化还原反应
解题思路
能应用电化学的基本只是原理进行迁移应用,准确应用电化学中有关原电池的相关结论加以解释和应用
易错点
对于燃料电池中的正负极判断、带电粒子在电池中的移动方向、电极反应式书写
知识点
11.某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是
正确答案
解析
在乙图装置中,Cu易失电子作负极、Cu作负极,当电流计中指针发生偏转时,盐桥中钾离子向正极移动,所以盐桥中的SO42-流向乙烧杯移动,Cu作负极,负极上Cu失电子发生氧化反应,电极反应式为Cu -2e-= Cu 2+,Pt为正极,正极上铁离子得电子发生还原反应,电极反应为Fe3++e-= Fe2+,甲烧杯中溶液的血红色逐渐变浅。若将甲烧杯中的溶液换成稀硝酸,稀硝酸属于强氧化剂其氧化性强于Fe3+,电流表指针依然是Pt为正极,Cu作负极。
考查方向
解题思路
原电池中,电子由负极经外电路流向正极,电解质溶液中,阳离子向正极移动,阴离子向负极移动;根据失电子难易程度确定正负极,再结合电解质溶液中离子移动方向分析解答,难点是电极反应式书写
易错点
根据失电子难易程度确定正负极。
知识点
9.铜及其化合物在工业上有许多用途。回答下列问题:
(1)某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:
①浸取反应中氧化剂的化学式为_______;滤渣Ⅰ的成分为MnO2、S和_______(写化学式)
②“除铁”这一步反应在25℃进行,加入试剂A调节溶液PH为4后,溶液中铜离子最大浓度不超过_______mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
③“沉锰”(除Mn2+)过程中反应的离子方程式______________。
④ 滤液Ⅱ经蒸发结晶得到的盐主要是_______(写化学式)。
(2)某实验小组同学用电化学原理模拟湿法炼铜,进行了一系列探究活动。
①如下左图为某实验小组设计的原电池装置,盐桥内装载的是足量用饱和氯化钾溶液浸泡的琼脂,反应前,电极质量相等,一段时间后,两电极质量相差6.00 g,则导线中通过了_______mol电子,若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,则甲、乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差_______g
②其他条件不变,若将盐桥换成光亮的U形弯铜丝浸入甲池与乙池,如上右图所示,电流计指针偏转方向与先前一样,但偏转角度明显减小。一段时间后,乙池石墨棒浸入液面以下部分也析出了一层紫红色固体,则甲池铜丝附近溶液的pH_______ (填“减小”、“增大”或“不变”) ,乙池中石墨为_______极(填“正”、“负”、“阴”或“阳”)
正确答案
(1)①MnO2 SiO2;
②2.2
③Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+;
④(NH4)2SO4
(2)①0.1;7.05
②增大;阴
解析
①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,所以根据方程式判断出浸取反应中氧化剂的为MnO2;根据物质的性质可以知道过滤得到滤渣为MnO2、SiO2、单质S,所以答案为:MnO2、SiO2;
②根据pH为4可以知道c(OH-)=10-10mol/L,再根据Ksp[Cu(OH)2]知道c(Cu2+)=Ksp/[c(OH-)2]=2.2mol/L;所以答案为2.2
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,所以该反应的离子方程式为:Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+;故答案为:Mn2+ +HCO3-+NH3 = MnCO3↓+ NH4+
④ 根据元素守恒判断滤液Ⅱ盐的主要成分。滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,故答案为:(NH4)2SO4 。
(2)①设导线中通过的电子的物质的量为x,则负极减少28 g·mol-1·x,正极增重32 g·mol-1·x,28x+32x=6,x=0.1mol。若不考虑甲、乙两池电解质溶液中的离子向盐桥中移动,根据盐桥的作用,甲池由于电极反应增加质量为2.8g,移动到甲池的Cl-也为0.1mol,质量增加3.55g,所以甲池总共增加(2.8+3.55)=6.35g,而乙池由于电极反应质量减少3.2g,移动到乙池的K+也为0.1mol,质量增加3.9g,所以乙池总共增加(3.9-3.2)=0.7g,所以乙两池电解质溶液的总质量与实验开始前的电解质溶液的总质量相差6.35+0.7 =7.05g。故答案为:0.1;7.05。
②乙池石墨棒析出了紫红色固体,则甲池为原电池,乙池为电解池,甲池中铜电极为正极,发生吸氧腐蚀反应,所以生成OH-,乙池中石墨电极为阴极;故答案为:增大;阴。
考查方向
解题思路
辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜。
①由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;
②根据Ksp[Cu(OH)2]进行计算;
③“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;
④ 根据元素守恒判断滤液Ⅱ盐的主要成分。滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体.
(2)①根据导线中通过的电子的物质的量与两个电极质量变化的关系求解;
②乙池石墨棒析出了紫红色固体,则甲池为原电池,乙池为电解池,甲池中铜电极为正极,发生吸氧腐蚀反应,所以生成OH-,乙池中石墨电极为阴极;
易错点
不能有效提取图表中信息,阅读材料、接受信息的能力不强,物质的分离提纯的方法掌握不熟练,不能通过化合价变化确立氧化剂,不能根据Ksp[Cu(OH)2]进行有关计算,不能根据原子守恒确立断滤液的主要成分,没有理解盐桥的作用。
知识点
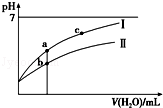
11.已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、 HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是
正确答案
解析
根据表中电离常数可知:酸性由强至弱的顺序为CH 3 COOH>H 2 CO 3 >HClO>HCO,结合质子的能力由大到小的顺序为>ClO- >>CH 3 COO- 。
A项, ClO- 的水解程度大于CH 3 COO- 的水解程度,同浓度CH 3 COONa和NaClO的混合液中,各离子浓度的大小关系应是 c (Na+ )> c (CH 3 COO- )> c (ClO- )> c (OH- )> c (H+ ),错误;
B项, 结合质子的能力大于ClO- 结合质子的能力,离子方程式应为ClO- +CO 2 +H 2 O=HClO+,错误;
C项, 分子、分母同乘以溶液中 c (H+ ),得,该式即为 K 电离 / K w ,温度相同则该式的值相等,正确;
D项, CH 3 COOH的酸性强于HClO,pH相同时,HClO的浓度大于CH 3 COOH的浓度,错误。
考查方向
解题思路
由表格可知,酸性的强弱顺序为CH3COOH >H2CO3> HClO>HCO3-,大于A中相同浓度CH3COONa和NaClO的混合液中,由于醋酸酸性强于次氯酸,则NaClO的水解程度CH3COONa,则溶液中c(CH3COO﹣) >c(ClO﹣),;B、由于酸性H2CO3> HClO>HCO3-,则向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO﹣+CO2+H2O═HClO+HCO3﹣;C、由图象可知,稀释过程中,Ⅰ的变化程度更大,则Ⅰ为酸性更强的CH3COOH,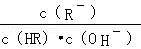
易错点
1、溶液导电能力大小与溶液中自由移动离子成正比,与电解质强弱无关,为易错点。
2、弱电解质的电离要根据酸的电离常数与酸根离子水解程度、酸的酸性强弱等知识点来分析解答。
知识点
11.一种熔融碳酸盐燃料电池工作原理如图所示。则下列推断错误的是( )
正确答案
解析
A.负极上CO和H2被氧化生成二氧化碳和水,电极A反应为:H2+CO+2CO32﹣﹣4e﹣=H2O+3CO2,有二氧化碳生成,故A正确;
B.正极为氧气得电子生成CO32﹣,反应为O2+2CO2+4e﹣=2CO32﹣,故B正确;
C.反应CH4+H2O
D.熔融碳酸盐为电解质,应在高温下进行工作,常温下不能形成原电池,故D错误。故选D。
考查方向
解题思路
甲烷和水经催化重整生成CO和H2,反应中C元素化合价由﹣4价升高到+2价,H元素化合价由+1价降低到0价,原电池工作时,CO和H2为负极反应,被氧化生成二氧化碳和水,正极为氧气得电子生成CO32﹣,以此解答该题。
易错点
化学电源新型电池,易错点点在明确原电池中物质得失电子、电子流向、离子流向,难点是电极反应式书写,要根据电解质确定正负极产物。
知识点
9.如图所示,甲池的总反应式为:N2H4+O2═N2+2H2O下列关于该电池工作时说法正确的是
正确答案
解析
A、甲池中为原电池反应,对应的电极反应式是:正极O2+4e-+2H2O=4OH-,负极N2H4-4e-+4OH-=N2+4H2O,故A错误;
B、甲池中因反应生成了水会使溶液的pH值减小,乙池中因反应生成了酸也会使溶液的pH值减小,故B错误;
C、选项中没说明气体的体积是否是标准状况下,所以气体的物质的量无法计算,则乙中生成的固体的质量也无法计算,故C错误;
D、乙池发生的是电解池反应,其电解总反应的离子方程式为:2Cu2++2H2O 通电2Cu+4H++O2↑,两极析出的分别是Cu和O2,因而加CuO后溶液能够复原,故D正确.
故选D.
考查方向
本题主要考查了原电池和电解池的工作原理
解题思路
本题考查了原电池、电解池工作的基本原理,以及原电池电极反应式的书写,注意把握原电池和电解池中电极方程式的书写方法。由图可知,甲为原电池,乙为电解池,甲池的总反应式为:N2H4+O2═N2+2H2O,则通过化合价的变化可知,N2H4的化合价升高,为负极,但电解质溶液为KOH,则电极反应为N2H4﹣4e﹣+4OH-═N2+4H2O,
甲池中生成了水,导致甲池中的PH变小;C中没有指明是否为标准状况下,不能进行计算;乙池中的总反应为2CuSO4+2H2O=2H2SO4+2Cu+O2,加入CuO,可与硫酸发生反应,生成硫酸铜,恢复到原浓度。
易错点
1、原电池和电解池中电极方程式的书写方法。
2、通过化合价的变化判断电极的正负极。
知识点
12.下列实验的实验目的、图示操作和实验现象均正确的是
正确答案
D
解析
A、淀粉在唾液与硫酸条件下发生水解,会生成葡萄糖,不会遇碘变蓝,错误;
B、二氧化氮转化为四氧化二氮为放热反应,温度高时,平衡右移,二氧化氮浓度增大,颜色加深,所以现象应为右边烧瓶内气体颜色变深,左边烧瓶内气体颜色变浅,错误;
C、图中左试管内液面产生气泡,右试管无明显现象,说明醋酸的酸性强于碳酸,碳酸的酸性强于硼酸,正确;
D、外加电流的阴极保护法,应为电解池,图中为原电池,错误,所以答案为D。
考查方向
本题主要考查了化学实验方案的评价;非金属在元素周期表中的位置及其性质递变的规律;化学平衡;原电池;
解题思路
本题综合考查化学实验基本操作,为高考常见题型,侧重于学生的分析能力、实验能力和评价能力的考查,有利于培养学生的实验能力和学习的积极性,注意把握实验原理以及实验操作方法和注意事项。
易错点
1、温度对化学平衡移动的影响。
2、侧重于学生的分析能力、实验能力。
知识点
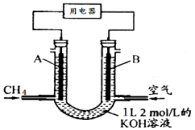
12.将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )
正确答案
解析
A.燃料电池中,通入CH4的一端为原电池的负极,OH-向负极移动;
B.当0<V≤22.4L时,0<n(CH4)≤1mol,则0<n(CO2)≤1mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,故B错误;
C.当22.4 L<V≤44.8L,1mol<n(CH4)≤2mol,则1mol<n(CO2)≤2mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故C正确;
D.当V=33.6L时,n(CH4)=1.5mol,n(CO2)=1.5mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到0.5molK2CO3和1molKHCO3的溶液,则c(HCO3-)>c(CO32-)>c(OH-),故D错误
考查方向
解题思路
燃料电池中,通入CH4的一端为原电池的负极,OH-向负极移动;
n(KOH)=2mol/L×1L=2mol,当0<V≤22.4L时,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应,由此分析解答。
易错点
不能准确判断电极、不能熟练书写电离反应、不能准确判断离子浓度。
知识点
扫码查看完整答案与解析