- 电解质溶液的导电性
- 共60题
6.常温下,关于pH = 2的盐酸,下列说法不正确的是( )
正确答案
解析
A.常温下,由于溶液的pH = 2,所以溶液中c(H+) = 1.0ⅹ10-2 mol·L-1,所以A正确;
B.常温下,pH=2的盐酸中氢离子浓度为1.0ⅹ10-2mol/L,盐酸溶液中氢氧根离子为水电离的,浓度为1.0×10-12,所以由H2O电离出的c(H+)=1.0×10-12mol•L-1,所以B正确;
C.由于盐酸为强酸,所以加水稀释10n倍后,溶液的pH增加n;所以稀释100倍后,溶液的pH 增加2,pH=4,所以C正确;
D.一水合氨为弱电解质,溶液中部分电离,pH=12的氨水溶液中c(OH-)=1.0ⅹ10-2mol/L,pH=2的盐酸中氢离子浓度c(H+) = 1.0ⅹ10-2 mol·L-1,所以等体积的氨水与盐酸混合,氨水中还有过量的一水合氨,导致溶液显示碱性,所以D错误。
考查方向
强、弱电解质在水溶液中的电离平衡及多水的电离平衡的影响。
解题思路
A.常温下,由于溶液的pH = 2,所以溶液中c(H+) = 1.0ⅹ10-2 mol·L-1;
B.常温下,pH=2的盐酸中氢离子浓度为1.0ⅹ10-2mol/L,盐酸溶液中氢氧根离子为水电离的,浓度为1.0×10-12,所以由H2O电离出的c(H+)=1.0×10-12mol•L-1;
C.由于盐酸为强酸,所以加水稀释10n倍后,溶液的pH增加n;
D.一水合氨为弱电解质,溶液中部分电离,pH=12的氨水溶液中c(OH-)=1.0ⅹ10-2mol/L,pH=2的盐酸中氢离子浓度c(H+) = 1.0ⅹ10-2 mol·L-1,所以等体积的氨水与盐酸混合,氨水中还有过量的一水合氨,导致溶液显示碱性。
易错点
酸溶液中存在两种H+,由水电离的H+和有酸电离的H+,其中水电离的H+浓度一定等于溶液中的OH-。
知识点
5.下列表述不正确的是( )
正确答案
解析
A、原电池中阴离子移向负极,阳离子移向正极,该原电池锌、硫酸锌溶液为负极,则Cl-移向ZnSO4溶液,故A正确;
B、电解池,a与正极相连是阳极,溶液中氯离子失电子生成氯气,2Cl--2e-=Cl2↑,氯气和碘化钾反应生成碘单质,使湿润的淀粉碘化钾试纸变蓝,故B正确;
C、精炼铜,粗铜作阳极,反应为Cu-2e-=Cu2+,故C不正确;
D、吸氧腐蚀,正极反应为O2+4e-+2H2O=4OH-,故D正确;
考查方向
本题主要考查电化学的相关知识。
解题思路
C项铜的电解精炼,粗铜为阳极,电极反应式为: Cu-2e-=Cu2+。
易错点
不能掌握原电池和电解池的工作原理。
知识点
4.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
正确答案
解析
A、糖类物质组成是由C、H、O三种元素组成,单不能简单为认为是碳水化合物,例如甲醛
B、从图形中得知MnO2变成Mn2+发生了化合价降低过程中,因此左边为正极反应,该燃料电池应用了MnO2做氧化剂。C、在电池内部正电荷向正极移动。D、当电路中需要转移6NA电子时,需要消耗的葡萄糖为45g
考查方向
本题考查电化学内容,主要考察了学生对燃料电池的理解应用以及氧化还原反应
解题思路
能应用电化学的基本只是原理进行迁移应用,准确应用电化学中有关原电池的相关结论加以解释和应用
易错点
对于燃料电池中的正负极判断、带电粒子在电池中的移动方向、电极反应式书写
知识点
12.下列实验的实验目的、图示操作和实验现象均正确的是
正确答案
D
解析
A、淀粉在唾液与硫酸条件下发生水解,会生成葡萄糖,不会遇碘变蓝,错误;
B、二氧化氮转化为四氧化二氮为放热反应,温度高时,平衡右移,二氧化氮浓度增大,颜色加深,所以现象应为右边烧瓶内气体颜色变深,左边烧瓶内气体颜色变浅,错误;
C、图中左试管内液面产生气泡,右试管无明显现象,说明醋酸的酸性强于碳酸,碳酸的酸性强于硼酸,正确;
D、外加电流的阴极保护法,应为电解池,图中为原电池,错误,所以答案为D。
考查方向
本题主要考查了化学实验方案的评价;非金属在元素周期表中的位置及其性质递变的规律;化学平衡;原电池;
解题思路
本题综合考查化学实验基本操作,为高考常见题型,侧重于学生的分析能力、实验能力和评价能力的考查,有利于培养学生的实验能力和学习的积极性,注意把握实验原理以及实验操作方法和注意事项。
易错点
1、温度对化学平衡移动的影响。
2、侧重于学生的分析能力、实验能力。
知识点
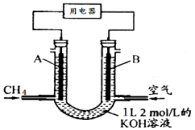
12.将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )
正确答案
解析
A.燃料电池中,通入CH4的一端为原电池的负极,OH-向负极移动;
B.当0<V≤22.4L时,0<n(CH4)≤1mol,则0<n(CO2)≤1mol,只发生反应①②,且KOH过量,则电池总反应式为CH4+2O2+2KOH=K2CO3+3H2O,故B错误;
C.当22.4 L<V≤44.8L,1mol<n(CH4)≤2mol,则1mol<n(CO2)≤2mol,发生反应①②③,得到K2CO3和KHCO3溶液,则负极反应式为CH4-8e-+9CO32-+3H2O=10HCO3-,故C正确;
D.当V=33.6L时,n(CH4)=1.5mol,n(CO2)=1.5mol,则电池总反应式为3CH4+6O2+4KOH=K2CO3+2KHCO3+7H2O,则得到0.5molK2CO3和1molKHCO3的溶液,则c(HCO3-)>c(CO32-)>c(OH-),故D错误
考查方向
解题思路
燃料电池中,通入CH4的一端为原电池的负极,OH-向负极移动;
n(KOH)=2mol/L×1L=2mol,当0<V≤22.4L时,可能先后发生反应①CH4+2O2→CO2+2H2O、②CO2+2KOH=K2CO3+H2O、③K2CO3+CO2+H2O=2KHCO3根据甲烷的量计算生成的二氧化碳的量,结合反应方程式判断反应产物及发生的反应,由此分析解答。
易错点
不能准确判断电极、不能熟练书写电离反应、不能准确判断离子浓度。
知识点
扫码查看完整答案与解析