- 电解质溶液的导电性
- 共60题
11.乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2 =CH2 + O2 → 2CH3CHO。下列有关说法正确的是
正确答案
解析
A.a电极是原电池负极,失电子,发生氧化反应,A错误;B.放电时,1molO2得到4mol电子,每转移2mol电子,理论上需要消耗28g乙烯,B正确;C.正极得到电子,发生还原反应,因此氧气在正极放电,电极反应式为O2 +4e- + 4H+ =2H2O, C错误;D.原电池中负极失去电子,乙烯在负极通入,但电子只能通过导线和电极传递,不能通过溶液传递,D错误;故选B。
考查方向
解题思路
A.a电极是原电池负极,失电子,发生氧化反应;B.放电时,1molO2得到4mol电子,每转移2mol电子,理论上需要消耗28g乙烯;C.正极得到电子,发生还原反应,因此氧气在正极放电,电极反应式为O2 +4e- + 4H+ =2H2O;D.原电池中负极失去电子,乙烯在负极通入,但电子只能通过导线和电极传递,不能通过溶液传递;
易错点
本题考查了原电池原理的应用,为高频考点,注意掌握电极方程式的书写是解决本题的关键,易错点为D,注意电子不能流经溶液,题目难度中等。
知识点
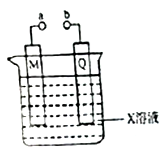
16.对下列由电极和电解质溶液构成的装置叙述不正确的是
正确答案
解析
A.若X、M、Q分别是H2SO4、Pb和PbO2,则该装置为铅蓄电池,铅蓄电池放电时,正极上PbO2得电子被还原,电极反应式为PbO2+SO42-+2e-+4H+═PbSO4+2H2O,负极上铅失电子发生氧化反应,电极反应式为Pb(s)+SO42-(aq)-2e-=PbSO4(s),都生成PbSO4,所以A正确;B.若X、M、Q分别是Na2SO4、C和Fe,a、b相连时形成原电池,铁为负极,由于负极附近的H+放电生成H2所以负极附近有OH-产生,使酚酞变,所以B正确;C.若X、M、Q分别CuSO4、Cu和Fe,a、b是分别连接电源的正负极,为电镀装置,铜为阳极,可在铁上镀铜,故C正确;D.若X、M、Q分别是NaCl、C和Fe,则a、b连接后,铁发生吸氧腐蚀,没有气体生成,故D错误。
考查方向
解题思路
A.若X、M、Q分别是H2SO4、Pb和PbO2,则该装置为铅蓄电池,铅蓄电池放电时,正极上PbO2得电子被还原,生成PbSO4,负极上铅失电子发生氧化反应,也生成PbSO4;B.若X、M、Q分别是Na2SO4、C和Fe,a、b相连时形成原电池,铁为负极,由于负极附近的H+放电生成H2所以负极附近有OH-产生,使酚酞变;C.若X、M、Q分别CuSO4、Cu和Fe,a、b是分别连接电源的正负极,为电镀装置,铜为阳极,可在铁上镀铜;D.若X、M、Q分别是NaCl、C和Fe,则a、b连接后,铁发生吸氧腐蚀,没有气体生成。
易错点
不能准确对原电池和电解池工作原理以及构成条件进行区别。
知识点

正确答案
D
解析
K1 与 K2连接是原电池,A.中铁是负极,石墨是正极,电解质溶液是中性的食盐水,故为铁的吸氧腐蚀,A.正确;
B.中较活泼的锌为负极,铁为正极,相当于钢铁防护中牺牲阳极的阴极保护法,B.正确;
K1 与K3连接是电解池,C.中石墨与电源的正极相连是阳极,食盐水中的氯离子在阳极放电生成氯气,铁与电源负极相连是阴极,溶液中氢离子放电生成氢气,为电解饱和食盐水,故C正确;
D.中铁连接电源的正极,是阳极,铁放电被氧化,没有被保护,故与“钢铁防护中外加电流的阴极保护法”不符,D选项错误。
考查方向
解题思路
K1 与 K2连接是原电池、 K1 与K3连接是电解池。
易错点
K1 与 K2连接、 K1 与K3连接所形成的原电池与电解池原理。
知识点
11.【化学——选修2:化学与技术】
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1 000 ℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转化为低价氧化物。该过程中两个主要反应的化学方程式是________、___________,反射炉内生成炉渣的主要成分是________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1 200 ℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是:
_________________________、______________________。
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板是图中电极________(填图中的字母);在电极d上发生的电极反应式为: _______________________________;
若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为
___________________________。
正确答案
(1)2Cu2FeS2+O2

(2)2Cu2S+3O2

(3)c;Cu2++2e-=Cu;Au、Ag以单质的形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中
解析
铜矿与空气反应生成Cu2S、FeS,根据化合价升降相等配平
c连电源正极,d连电源的负极;故c为阳极,d为阴极;粗铜板应放在阳极,即c;d阴极发生还原反应,方程式为:Cu2++2e-=Cu;Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中,
故答案是:c;Cu2++2e-=Cu;Au、Ag以单质形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中.
考查方向
工业流程、电化学基础、氧化还原反应
解题思路
精读题干信息,提取相关内容准确判断产物类型,应用元素守恒以及氧化还原正确书写化学方程式,依据电解池相关基础分析电解池内部的各种变化及其电化学规律
易错点
方程式书写
知识点
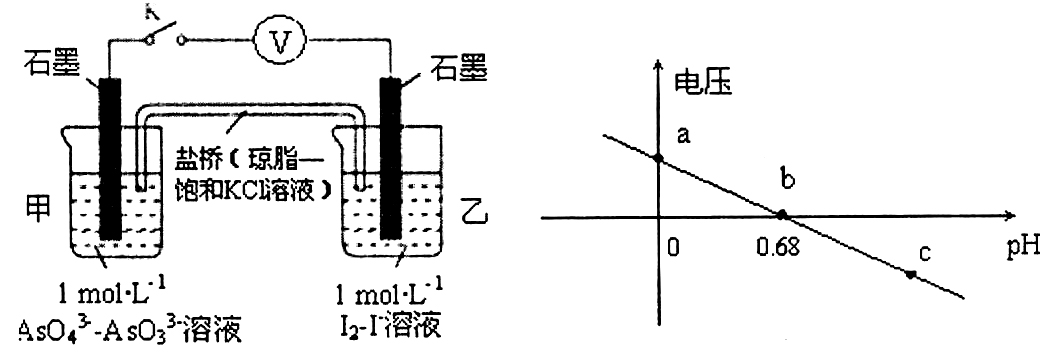
16.某实验小组依据反应AsO43-+2H++2I-
正确答案
解析
A.a点时,pH<0.68,反应向正方向进行,乙池石墨电极为负极,盐桥中K+向左移动,正确;
B.b点时,pH=0.68,电压为0,反应处于相对静止状态,即化学平衡状态,正确;
C.c点时,pH增大,即氢离子浓度减小,反应向逆方向进行,正极的电极反应为I2+2e-=2I-,错误;
D.pH>0.68时,电压小于0,反应逆向进行,碘作氧化剂,所以氧化性I2>AsO43-,正确;故选C。
考查方向
解题思路
当pH=0.68时,电压为0,反应处于相对静止状态,即化学平衡状态;pH增大,即氢离子浓度减小,反应向逆方向进行;pH减小,即氢离子浓度增大,反应向正方向进行;
易错点
b点时,pH=0.68,电压为0,反应处于相对静止状态,即化学平衡状态
知识点
扫码查看完整答案与解析