- 电解质溶液的导电性
- 共60题
6.依据下列事实或实验得出结论正确的是
正确答案
D
解析
A.原电池是将化学能转化成电能,是最初始的供电装置,本身可作为电源,不需要外接电源,故错误。
B.氯水具有强氧化性能将亚铁氧化成三价,如果原溶液中已有三价铁将对亚铁的检验产生影响,因此实验不够严谨,未能排除三价铁的存在,故错误。
C.自发进行的方向应该有吉布斯自由能判断,即由焓变和熵变综合考虑,故错误。
D.氯分子能置换出溴分子,根据氧化还原反应中氧化剂还原剂强弱比较规律的得出正确结论,故正确。
考查方向
解题思路
准确把握实验现象与结论之间的科学关联,实验结论的科学性
易错点
现象与结论之间的因果关系的判断
知识点
【科目】化学
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:
请回答:
19.已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是 价。
20.化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
21.煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:
4Fe(CrO2)2+8Na2CO3+7O2
为了加快该反应的反应速率,可采取的措施是 。
22.已知CrO42—在不同的酸性溶液中有不同的反应,如:
2CrO42- + 2H+ 

①往混合溶液甲中加入硫酸必须适量的原因是 。
②混合溶液乙中溶质的化学式是 。
23.+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr( OH)3沉淀而被除去。
a电极的电极反应式是 ,
b电极附近反应的离子方程式是 。
正确答案
+2
解析
:Fe(CrO2)2中,氧元素的化合价是-2价,总的负价是-8价,铬元素的化合价是+3价,2个铬原子化合价是+6价,所以铁元素化合价是+2价,
故答案为:+2
考查方向
解题思路
根据正负总化合价之和相等进行分析;
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
正确答案
FeO·Cr2O3
解析
:Fe(CrO2)2 中铁元素化合价是+2价,氧化物为FeO,铬元素化合价+3价,氧化物为Cr2O3,所以Fe(CrO2)2写成氧化物形式为FeO•Cr2O3,故答案为:FeO•Cr2O3 ;
考查方向
解题思路
类比Na2SiO3可写成Na2O•SiO2完成Fe(CrO2)2的氧化物的形式;
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
正确答案
粉碎矿石,升高温度。
解析
: 增大反应物接触面积可以加快反应速率,升高温度可以大大加快反应速率,
故答案为:粉碎矿石、升高温度;
考查方向
解题思路
根据影响化学反应速率的因素分析;
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
正确答案
① 少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物。
② Na2Cr2O7和Na2SO4
解析
:①由于少量难以除尽碳酸钠,过量会发生反应3CrO42-+4H+=Cr3O102-+2H2O,生成了Na2Cr3O10等副产物,所以必须加入适量硫酸,故答案为:少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;②由于发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4,所以乙中溶质的化学式Na2Cr2O7和Na2SO4,故答案为:Na2Cr2O7和Na2SO4;
考查方向
解题思路
①固体图示及题中信息可知,少量不能除尽Na2CO3等杂质,过量会生成Na2Cr3O10等副产物;②发生了反应2CrO42-+2H+=Cr2O72-+H2O,生成了Na2Cr2O7和Na2SO4;
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
正确答案
2H+ + 2e- = H2↑,Cr2O
解析
:根据电解槽图示可知,a为阴极,溶液显示酸性,溶液中氢离子得到电子,发生还原反应,电极反应为:2H++2e-=H2↑,
b为阳极,铁失去电子生成亚铁离子,亚铁离子被Cr2O72-氧化成铁离子,反应的方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案为:2H++2e-=H2↑,Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
考查方向
解题思路
a连接电源负极,所以a为阴极;b连接电源正极,所以b为电解槽的阳极;阳极发生氧化反应,阴极发生还原反应.
易错点
重铬酸钠的制取原理及除杂方法,涉及了电极知识的应用
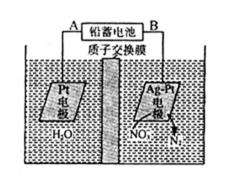
13.用电解法处理含硝(NO3-)废水的原理如图所示。下列说法错误的是
正确答案
解析
A.根据图示可知:在右边的Pt-Ag电极上NO3-得到电子被还原变为N2;所以该电极是阴极,与之连接的B是负极,A是正极。铅蓄电池的A极为正极,电极材料为PbO2,正确;B.铅蓄电池工作过程中负极发生反应:Pb-2e-+SO42-=PbSO4↓,所以负极质量增加,正确;C.该电解池的阴极反应为:2NO3-+ 6H2O + 10eˉ =N2↑ + 12OHˉ,正确;D.在阳极发生反应:2H2O-4e-=4H++O2↑;若电解过程中转移2moL电子,会消耗1mol的水,产生的2mol的H+进入阴极室,阳极质量减轻18g,在阴极室发生反应:2NO3-+ 6H2O + 10eˉ =N2↑ + 12OHˉ,若转移2mol的电子,会产生0.2mol的N2从溶液中逸出,同时有由2mol的H+进入该室,则阴极室实际减轻的质量是0.2mol×28g/mol-2g=3.6g,则两侧电解液的质量变化差(Δm右-Δm左)为18g-3.6g=14.4g,错误。
考查方向
解题思路
A.该装置中,硝酸根离子得电子发生还原反应,则Ag-Pt电极为阴极、Pt电极为阳极,连接阳极的电极为正极;B.铅蓄电池工作过程中负极为Pb失电子生成硫酸铅;C.阴极上硝酸根离子得电子发生还原反应;D.转移2mol电子时,阳极(阳极反应为H2O失电子氧化为O2和H+)消耗1mol水,产生2molH+进入阴极室,阳极室质量减少18g;阴极室中放出0.2molN2(5.6g),同时有2molH+(2g)进入阴极室;
易错点
易错点为D选项,注意氢离子还进入阴极室,若往只考虑析出的气体会导致错误,
知识点
硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是________。查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向 右偏转。① 反应后的溶液中含NH4+。实验室检验NH4+的方法是________。② 生成NH4+的电极反应式是________。
进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:
① 观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的解释是________。 ② A中生成NH3的离子方程式是________。
将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由________。
实验Ⅰ中,铝片作________(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是________。
正确答案
Al开始作电池的负极,Al在浓硝酸中迅速生成致密氧化膜后,Cu作负极
解析
Al开始作电池的负极,Al在浓硝酸中迅速生成致密氧化膜后,Cu作负极
考查方向
解题思路
根据题目所给的电流计指针偏转情况分析此时所发生的氧化还原反应,并根据对产物现象的描述分析此时的产物,所以可以看出对信息的分析和既有知识的联系是解此题的关键。
易错点
原电池需要自发的氧化还原反应,铝在常温下会与浓硝酸发生钝化而反应不能持续发生,电极就发生了转变。
正确答案
① 取少量待检溶液于试管中,加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则溶液中含NH4+② NO3-+8e-+10 H+=NH4++3H2O
解析
①考查铵根离子的检验: 取少量待检溶液于试管中,加入浓NaOH溶液,加热,若产生使湿润的红色石蕊试纸变蓝的气体,则溶液中含NH4+②根据题目所给产物是NH4+, NO3-+8e-+10 H+=NH4++3H2O
考查方向
解题思路
根据题目所给的电流计指针偏转情况分析此时所发生的氧化还原反应,并根据对产物现象的描述分析此时的产物,所以可以看出对信息的分析和既有知识的联系是解此题的关键。
易错点
原电池需要自发的氧化还原反应,铝在常温下会与浓硝酸发生钝化而反应不能持续发生,电极就发生了转变。
正确答案
① Al与NaOH溶液反应产生H2的过程中可将NO3-还原为NH3,而Mg不能与NaOH溶液反应 ② 8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-
解析
① Al与NaOH溶液反应产生H2的过程中可将NO3-还原为NH3,而Mg不能与NaOH 溶液反应② 8Al+3NO3-+5OH-+2H2O=3NH3↑+8AlO2-
考查方向
解题思路
根据题目所给的电流计指针偏转情况分析此时所发生的氧化还原反应,并根据对产物现象的描述分析此时的产物,所以可以看出对信息的分析和既有知识的联系是解此题的关键。
易错点
原电池需要自发的氧化还原反应,铝在常温下会与浓硝酸发生钝化而反应不能持续发生,电极就发生了转变。
正确答案
因为铝与中性的硝酸钠溶液无生成H2的过程,NO3-无法被还原。
解析
因为铝与中性的硝酸钠溶液无生成H2的过程,NO3-无法被还原。
考查方向
解题思路
根据题目所给的电流计指针偏转情况分析此时所发生的氧化还原反应,并根据对产物现象的描述分析此时的产物,所以可以看出对信息的分析和既有知识的联系是解此题的关键。
易错点
原电池需要自发的氧化还原反应,铝在常温下会与浓硝酸发生钝化而反应不能持续发生,电极就发生了转变。
正确答案
解析
铝比铜活泼,作负极 气体在页面上方便为红棕色2NO+O2=2NO2
考查方向
考查元素化合物知识和实验探究能力
解题思路
根据题目所给的电流计指针偏转情况分析此时所发生的氧化还原反应,并根据对产物现象的描述分析此时的产物,所以可以看出对信息的分析和既有知识的联系是解此题的关键。
易错点
原电池需要自发的氧化还原反应,铝在常温下会与浓硝酸发生钝化而反应不能持续发生,电极就发生了转变。
4.一定条件下,实验室利用右图所示装置,通过测电压求算 Ksp(AgCl)。工作一段时间后,两电极质量均增大。下列说法错误的是( )
正确答案
解析
A、该电池是原电池,将化学能转化为电能,故A正确;B、银失电子发生氧化反应为负极,而不是正极,故B错误;C、总的电极反应式为:Ag++Cl-═AgCl↓,故正确;D、阳离子向正极移动,左池是负极右池是正极,所以盐桥中的K+向右池方向移动,故D正确;故选B.
考查方向
解题思路
A、该电池是原电池;
B、银失电子发生氧化反应为负极;
C、总的电极反应式为:Ag++Cl-═AgCl↓;
D、阳离子向正极移动.
易错点
原电池正负极化学式的书写
知识点
扫码查看完整答案与解析