- 电解质溶液的导电性
- 共60题
18. LiFePO4用于锂离子二次电池的电极材料,可由LiI和FePO4制备。
(1)FePO4难溶于水,制备方法如下:
Ⅰ.用稍过量的稀H2SO4溶解废铁屑,加热,搅拌,过滤;
Ⅱ.向滤液中加入一定量的H2O2;
Ⅲ.向含Fe3+的溶液加入Na2HPO4溶液,过滤后经进一步处理得FePO4。
①Ⅰ中反应进行完全的现象是 。
② 用离子方程式说明H2O2的作用是 。
③ 已知:H2PO -4 

产生FePO4的离子方
④ Na2HPO4溶液显碱性的原因是 。
(2)制备LiFePO4:将FePO4与LiI混合,在惰性气氛中加热,制得LiFePO4 。
化合物LiI中碘离子的作用是 。

池反应为: FePO4(s) +Li(s) LiFePO4(s) ,装置如下:
①该电池不能用电解质水溶液,原因是 。
②充电时,b极的电极反应式是 。
正确答案
(1)① 不再产生气泡 (2 分)
② 2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O (2 分)
③ Fe3+ + 2HPO42- = FePO4↓+ H2PO4- (2 分)
④ 由于HPO42-可以电离:HPO42- 
H2PO4- + OH-,且水解程度大于电离程度,所以溶液溶解显碱性。(2 分)
(2)作还原剂 (1 分)
(3)① 金属Li可与水发生反应(或2Li + 2H2O =2LiOH + H2↑)(1 分)
② LiFePO4 - e- = Li+ + FePO4 
知识点
16. 甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;②0.1 mol/L乙溶液中c(H+)>0.1 mol/L;③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
正确答案
解析
根据②中的信息:0.1mol/L乙溶液中c(H+)>0.1mol/L,说明乙是硫酸可知乙是二元酸,故乙是H2SO4;所以B正确;根据③中现象,可以推知丙中含有Cl-;再结合①中提供信息,甲与其它三种物质混合均产生白色沉淀,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,因此可推出甲是Ba(OH)2,故A正确;乙是H2SO4,丙是MgCl2,丁是NH4HCO3,故D正确,C错误;
考查方向
离子反应
解题思路
将甲溶液分别与其他三种物质的溶液混合,可以形成白色沉淀的只有BaSO4、BaCO3、Mg(OH)2,因此甲只能是Ba(OH)2;0.1mol/L乙溶液中c(H+)>0.1mol/L,说明乙是硫酸;向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成,说明丙是MgCl2,所以丁是NH4HCO3
易错点
离子相互之间不能共存
教师点评
本题为离子反应推断题,做题时注意题中的反应现象,找出突破口,抓住物质的性质是关键
知识点
4. 电化学半导体CO气体传感器可用于监测环境中CO的含量,其工作原理示意图如下。下列说法不正确的是( )
正确答案
解析
A.O2在对电极上得到电子发生还原反应。
B.由正极 O2+4e-+4H+=== 2H2O可见溶液中H+向对电极移动
C.得失电子总量守恒,O2得4e-CO失2e-反应消耗的CO与O2的物质的量之比为2∶1
D.负极的电极反应式为CO-2e-+2OH-=CO2+H2O
考查方向
解题思路
该电池的电极反应式为
正极: O2+4e-+4H+=== 2H2O(对电极)
负极: CO-2e-+H2O =CO2+2H+(工作电极)
易错点
。
知识点
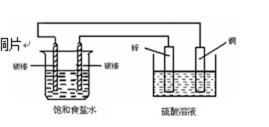
10. 关于右图装置中的变化叙述错误的是
正确答案
解析
右边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,
A.电子从负极锌沿导线流向右侧碳棒,再从左侧碳棒流回正极铜片,故A正确;
B.锌片上失电子发生氧化反应,铜片上发生还原反应,故B错误;
C.左侧碳棒是电解池阳极,阳极上应该是氯离子放电生成氯气,右侧碳棒是阴极,该电极上发生的反应:2H++2e-→H2↑,故C正确;
D.铜电极是正极,正极上氢离子得电子析出氢气,故D正确;
考查方向
原电池和电解池的工作原理
解题思路
右边装置能自发的进行氧化还原反应,所以右边装置是原电池,锌易失电子而作负极,铜作正极;左边装置连接外加电源,所以是电解池,连接锌棒的电极是阴极,连接铜棒的电极是阳极,再结合原电池和电解池原理解答
易错点
原电池装置的判断;电子不进入电解质溶液
教师点评
本题主要考查原电池和电解池原理,正确判断原电池和电解池是解本题关键,难度不大。
知识点
19.能正确表示下列反应的离子反应方程式为
正确答案
解析
A、由于浓KOH溶液过量,所以NH4HCO3溶液中的NH4+、HCO3-完全反应,没有加热生成一水合氨,故化学方程式:NH4HCO3 +2KOH=K2CO3+NH3•H2O+H2O,NH4HCO3 、KOH 和 K2CO3均可以拆,故离子方程式为:NH4++HCO3-+2OH-═CO32-+NH3•H2O+H2O,故A正确;
B、明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,得出明矾和Ba(OH)2的比例为1:2,故离子方程式为Al3++2SO42-+2Ba2++4OH-═AlO2-↓+BaSO4↓+2H2O,故B错误;
C、向FeBr2溶液中通入足量氯气后,Fe2+和Br-均被完全氧化,故化学方程式:2FeBr2 +3Cl2 =2FeCl3 +2Br2,故离子方程式为:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C正确;
D、醋酸是弱酸,不能拆,故离子方程式为:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O,故D错误
考查方向
离子方程式正误判断
解题思路
A、由于浓KOH溶液过量,所以NH4HCO3溶液中的NH4+、HCO3-完全反应,没有加热生成一水合氨;
B、明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全,得出明矾和Ba(OH)2的比例为1:2;
C、向FeBr2溶液中通入足量氯气后,Fe2+和Br-均被完全氧化;
D、醋酸是弱酸,不能拆;
易错点
A项中因没有加热要写成NH3•H2O
教师点评
本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,注意离子反应中保留化学式的物质,题目难度不大
知识点
扫码查看完整答案与解析