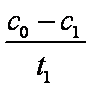- 化学反应速率和化学平衡
- 共523题
某酸性工业废水中含有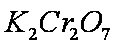
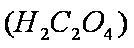
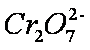
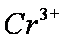
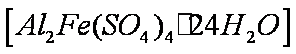
为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
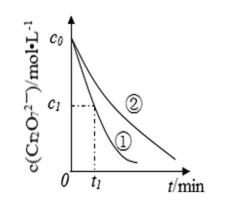
测得实验①和②溶液中的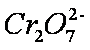
(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明 ;实验①中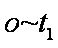
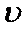
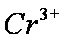
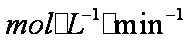
(4)该课题组队铁明矾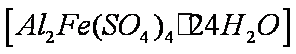
假设一: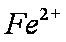
假设二: ;
假设三: ;
…………
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有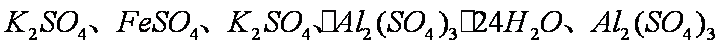
正确答案
(2)CO2
(3)PH越大,反应的速率越慢
(4)Al3+期催化作用;Fe2+和Al3+起催化作用
(5)取PH=5的废水60ml,加入10ml草酸和30ml蒸馏水,滴加几滴FeSO4,测定反应所需时间
预期现象与结论:与②对比,如果速率明显加快,故起催化作用的为Fe2+
解析
该反应为探究重铬酸根与草酸反应过程中的催化作用,该反应为一比较熟悉的反应,草酸被氧化后的产物为二氧化碳。
(3)考查了从图像中获取数据并分析的能力。图像越陡,反应速率越快
(4)对于假设可以从加入的物质铁明矾中获取,故为Fe2+和Al3+,然后根据上面的过程,进行对比实验,即可以得到答案。
知识点
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。据图分析,下列判断错误的是
正确答案
解析
略
知识点
在生活、生产中为增大反应速率而采取的措施合理的是
正确答案
解析
略
知识点
硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l) 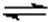
正确答案
解析
略
知识点
氯酸钾和亚硫酸氢钠起氧化还原反应生成Cl

正确答案
解析
略
知识点
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)在T℃和mPa时,将0.6molH2和0.4molN2置于一固定容积为2 L的密闭容器中发生反应:
3H2+N2
①0~8分钟NH3的平均生成速率为________mol·L-1·min-1。
②反应3H2+N2
(2)仍在T℃和mPa时,将0.6molH2和0.4molN2置于一容积可变的密闭容器中。(反应过程中保持温度压强不变)
①下列各项能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.3v(N2)(正) = v(H2)(逆)
c.3v(H2)(正) = 2v(NH3)(逆)
d.混合气体的密度保持不变
e.容器中气体的平均相对分子质量不随时间而变化
②该条件下达到平衡时NH3的体积分数与题(1)条件下NH3的体积分数相比________(填“变大”“变小”或“不变”)
③达到平衡后,改变某一条件使反应速率发生了如图所示的变化,改变的条件可能是________。
a.升高温度,同时加压
b.降低温度,同时减压
c.保持温度、压强不变,增大反应物浓度
d.保持温度、压强不变,减小生成物浓度
(3)NH3是合成硝酸的基础原料,请写出NH3在催化条件下被O2氧化的化学反应方程式________。
硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。氨气等能将氮氧化物还原为氮气和水,其反应机理为:
2NH3(g)+5NO2(g)=7NO(g) +3H2O(g); △H=-akJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+ 6H2O(g); △H=-bkJ·mol-1
则NH3直接将NO2还原为N2的热化学方程式为:________。
若标准状况下NO与NO2 混合气体40.32L (1.80 mol)被足量氨水完全吸收,产生标准状况下氮气42.56L (1.90 mol)。该混合气体中NO与NO2的体积之比为________。
正确答案
(1)①0.0125;②14.8
(2)①bde;②变小;③c
(3)4NH3+5O2Pt△4NO+6H2O;6NO(g)+4NH3(g)=5N2(g)+6H2O(g)△H=-(6a+7b/5)kJ·mol-1;1﹕2
解析
略。
知识点
7. 在恒容密闭容器中,反应
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积
为100L),在一定条件下发生反应:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
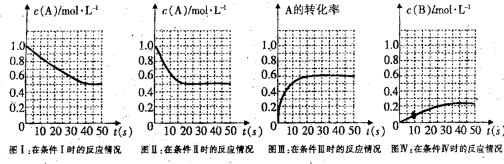
12.某探究小组研究

分析以上数据所得出的结论不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.在一体积不变的密闭容器中发生化学反应:2A(g)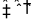
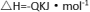

下列有关说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析