- 化学反应速率和化学平衡
- 共523题
26.半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。学科&网
正确答案
(1)硝酸铅(或硫酸铜);黑色沉淀(2)3:1(3)价廉;吸收CO2能力差碱液循环使用;2KHCO3→K2CO3+CO2↑+H2O
(4)
知识点
15. 已知反应:2CH3OH(g)
正确答案
解析
本题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0 分;若正确答案包括两个选项,只选一个且正确的得2 分,选两个且都正确的得满分,但只要选错一个,该小题就得0 分。
知识点
28.二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g),△H=-a kJ·mol-1(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol 
D.该体系中

②计算该温度下此反应的平衡常数K=_________。(保留两位有效数字)。若改变条件( )(填选项),可使K=1。
A.增大压强 B.增大反应物浓度
C.降低温度 D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为:( )。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(3)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) ⇌ CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________
正确答案
(1)
①AB
②0.20 C
(2)
①CH3OH-6e-+H2O=CO2+6H+
②2Cl-+2H2O 
(3)CH3OH(l) +

解析
解析已在路上飞奔,马上就到!
知识点
(18分)请运用化学反应原理的相关知识研究元素及其化合物的性质。
(1)工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:
正确答案
解析
略。
知识点
6.恒温恒容下向2 L密闭容器中加入SO3发生反应:2SO3(g) 
应过程中测定的部分数据如下表:
下列说法正确的是( )
正确答案
解析
2SO3(g) 
开始(mol/l) 1.0 0 0
0-2min变(mol/l) 0.6 0.6 0.3
2min末(mol/l) 0.4 0.6 0.3
4min末(mol/l) 0.4 0.6 0.3
4-6min变(mol/l) 0.5 0.5 0.25
6min末(mol/l) 0.9 0.1 0.5
A.0~2 min平均速率v(SO2) = 0.3 mol·L-1·min-1故A错
B.该反应正方向气体分子数目增大,减小压强,平衡正移,而数据显示逆移,说明不是减压。故B错。
C.2min已经达到平衡状态,算出K=0.3,升高温度,K增大,说明反应吸热,C正确。
D.反应物量减小一半,若平衡不移动,则生成物也为原平衡的一半,但反应物减小,压强减小,平衡正移,n(SO2)>0.6 mol
考查方向
本题考查了化学平衡移动,化学平衡状态的特征以及化学反应速率等知识点。
解题思路
见解析
教师点评
本题考查了化学平衡和反应速率的知识点,涉及知识点多,综合性较强,在高考中出现频率高,但一般在大题。
知识点
高炉炼铁过程中发生的主要反应为
已知该反应在不同温度下的平衡常数如下:
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
a.减少Fe的量
b.增加Fe203的量
c.移出部分C02
d.提高反应温度
e.减小容器的容积
f.加入合适的催化剂
正确答案
(1)K=
(2)0.006 mol·L-1·min-1;60%
(3)c
解析
本题主要考察化学反应速率的概念及计算、外界条件对化学平衡的影响、化学平衡常数的概念及计算以及反应热的有关判断。(1)平衡常数是指在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积当比值,但需要注意但是固体和纯液体的浓度视为常数,不能出现在表达式中;从表中数据可知随着温度的升高平衡常数逐渐减小,这说明温度升高平衡向逆反应方向移动,所以正反应是放热反应,即△H<0。(2)
在1000℃时K=4.0,所以有
因此C02的浓度变化量为:c(C02)=




CO的转化率为
(3)因为该反应是一个放热且体积不变的可逆反应,所以要提高CO的平衡转化率,可以采取降低温度或降低生成物浓度来实现,而固体和催化剂不能改变平衡状态,所以选项c正确。
知识点
化学反应原理在科研和生产中有广泛应用
(1)利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
TaS2(s)+2I2(g)
反应(I)的平衡常数表达式K= ,若K=1,向某恒容密闭容器中加入1mol I2(g)和足量TaS2(s),I2(g)的平衡转化率为
(2)如图所示,反应(I)在石英真空管中进行,先在温度为T2的一端放入未提纯的TaS2粉末和少量I2(g),一段时间后,在温度为T1的一端得到了纯净的TaS2晶体,则温度T1 T2(填“﹥”“﹤”或“=”)。上述反应体系中循环使用的物质是 。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为 ,滴定反应的离子方程式为
(4)25℃时,H2SO3 
mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中将 (填“增大”“减小”或“不变”)。
正确答案
(1)
(2)<,I2
(3)淀粉溶液,H2SO3+I2+H2O=4H++SO42-+2I-
(4)1.0×10-12,增大
解析
(1)
(2)由所给方程式可知该反应为吸热反应,通过题意温度T2端利于反应正向进行,为高温,温度T1端利于反应向左进行,为低温,所以T1<T2。I2是可以循环使用的物质。
(3)因为I2遇到淀粉会变蓝色,所以可以用淀粉溶液作指示剂.离子反应:H2SO3+I2+H2O=4H++SO42-+2I-.
(4)Ka=


知识点
研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)
2NO(g)+Cl2(g)
(1)4NO2(g)+2NaCl(s)
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后n(Cl2)=_______mol,NO的转化
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3-).c(NO2-)和c(CH3COO-)由大到小的顺序为_______。(已知HNO2的电离常数Ka=7.1×10-4mol•L-1,CH3COOH的电离常数K a=1.7×10-5mol•L-1,可使溶液A和溶液B的pH相等的方法是_______。
a. 向溶液A中加适量水
b. 向溶液A中加适量NaOH
c. 向溶液B中加适量水
d. 向溶液B中加适量NaOH
正确答案
(1)
(2)2.5x10-2; 75%;>;不变;升高温度
(3)c(NO3-)>c(NO2-)>c(CH3COO-);b.c
解析
略。
知识点
海水资源的利用具有广阔前景。海水中主要离子的含量如下:
(1)电渗析法淡化海水示意图如右图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。
①阳极主要电极反应式是 。
②在阴极附近产生少量白色沉淀,其成分有 和CaCO3,
生成CaCO3的离子方程式是 。
③淡水的出口为 (填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:
①提取溴的过程中,经过2次Br-→Br2转化的目的是 ,吸收塔中发生反应的离子方程式是 。解释通空气的目的是 。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是 、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为 L(忽略Cl2溶解,溴的相对原子质量:80)。
正确答案
(1)①(2分)2Cl—-2e—=Cl2↑
②(2分)Mg(OH)2 (2分)Ca2++ OH—+HCO3—=CaCO3↓+H2O
③(2分)b
(2)①(1分)对溴元素进行富集 (2分)SO2+Br2+2H2O=4H++2Br—+SO42—
(2分)通入空气将Br2蒸气带出
②(1分)加热浓缩、冷却结晶
③(2分)179.2
解析
略
知识点
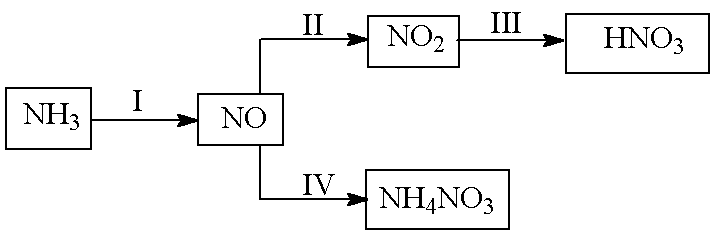
NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是________________________。
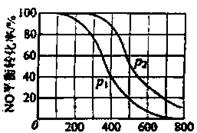
(2)II中,2NO(g) +O2(g) 
①比较p1.p2的大小关系_____________。
②随温度升高,该反应平衡常数变化的趋势是_______________。
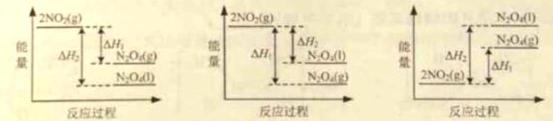
(3)III中,将NO2(g)转化成N2O4(l),再制备浓硝酸。
①已知:2NO2(g) 
2NO2(g) 
②N2O4与O2.H2O化合的化学方程式_________________________________________。
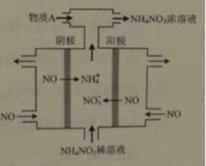
(4)IV中,电解NO制备NH4NO3,其工作原理如右图所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是________,说明理由:_____________________________________________________________。
正确答案
答案:(1)4NH3+5O2 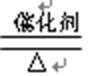
(2)①p2> p1 ②变小
(3)①A ②2N2O4+O2+2H2O=4HNO3
(4)NH3 根据电子守恒,阳极得到的NO3—的量大于阴极得到的NH4+的量,所以需充入NH3(或从阴阳极电极反应式说明也可)
解析
略
知识点
扫码查看完整答案与解析