- 化学反应速率和化学平衡
- 共523题
24.随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g)+4H2(g)
相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
(2)a、b、c、d与m、n、x、y之间的关系式为_________。
碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
(3)0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”“小于”或“等于”)
等浓度广东草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
(4)若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]b.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]c.[H+]>[HC2O4-]>[C2O42-]>[CO32-] d. [H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(5)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-
正确答案
(1)

(5)当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。(合力即给分)
知识点
19.向100mL0.1mol·L–1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1mol·L—1Ba(OH)2溶液。随着Ba(OH)2溶液体积(V)的变化,沉淀总物质的量(n)的变化如图所示。下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
20.电解原理在化学工业上有着广泛的应用,按下图所示所示装置进行电解实验。A.B.C.D均为惰性电极,开始电解前在甲装置的A.B极两侧各滴入酚酞试液。工作一段时间后:
(1)A极附近可观察到的现象是________________________;
检验B电极上反应产物的通常方法是_____________;
甲电池中电解反应的离子方程式是 ________________________;
溶液中还可能存在的离子反应方程式是 ____________________________。
(2)甲槽溶液的pH________(填“增大”.“不变”或 “减小”,下同);乙槽溶液的pH________。当A极上收集到22.4L气体(标准状况)时,乙装置的C极上可得到______g金属单质。
利用A.D两极上析出的物质制成的燃料电池,是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答(3)~(6):
(3)氢氧燃料电池的能量转化主要形式是_______,在导线中电子流动方向为_______(用a.b 表示)。
(4)负极反应式为____________。
(5)电极表面镀铂粉的原因为__________
(6)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
①反应Ⅰ中的还原剂是_______,反应Ⅱ中的氧化剂是_______。
②先用锂吸收224L(标准状况)H2,将生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为_______mol。
正确答案
(1)有无色无味的气体产生,溶液由无色变浅红色
将湿润的淀粉KI试纸放在B极附近,试纸变蓝
(2)增大 减小 64
(3)由化学能转化为电能 由a到b
(4)
(5) 增大电极单位面积吸附H2、O2的分子数,加速电极反应速率
(6) ①Li H2O ② 32
解析
解析已在路上飞奔,马上就到!
知识点
8. 下列叙述I和II均正确且具有因果关系的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:
反应① O3
反应② [O]+O3
总反应:2O3
(1)一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。
已知:O3的起始浓度为0.0216 mol/L。
在30°C、pH=4.0条件下,O3的分解速率为_______________ mol/ (L·min)。
(2)根据表中数据,推测O3在下列条件下分解速率由小到大的顺序为________。(填字母代号)
A,40°C、pH=3.0
B,10°C、pH=4.0
C,30°C、pH=7.0
(3)下列叙述正确的是
A,降低温度,K增大
B,K=K1+K2
C,适当升温,可提高消毒效率
D,压强增大,K2减小
正确答案
(1)1×10-4
(2)B<A<C
(3)AC
解析
略
知识点
一定条件下,通过下列反应可以制备特种陶瓷的原料
正确答案
解析
该反应为正方向体积增加且吸热。A、升高温度,平衡正向移动,气体的质量增加,密度增大,正确;B、增加co的量,平衡正向移动,但压强增大,转化的量,没有上一平衡多,故比值减小,错误;C、平衡常数只与温度有关,错误;D因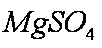
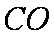
知识点
合成氨尿素工业生产过程中涉及到的物质转化过程如下图所示。
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为 。
(2)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来。运用化学平衡的
知识分析这样做的是否有利于氨的合成
(3)右图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。
①若分别用υA(NH3)和υB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则υA(NH3) υB(NH3)(填“>”、“<”或“=”)。
②在相同温度、当压强由p1变为p3时,合成氨
反应的化学平衡常数 。(填“变大”、“变小”或“不变”)。
③在250℃、1.0×104 kPa下,H2的转化率为 %(计算结果保留小数点后
1位)。
(4)NH3(g) 与CO2(g) 经过两步反应生成尿素,
NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为 。
(5)运输氨时,不能使用铜及其合金制造的管道阀门。因为,在潮湿的环境中,金属
铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,该反应的离子方程
式为 。
正确答案
见解析。
解析
(1)
(2)移走氨气,减小生成物浓度,平衡右移,有利于氨生成
(3)① <
② 不变
③ 66.7%
(4)2NH3(g) + CO2(g) === CO(NH2)2(s) + H2O(l) △H = -134 kJ/mol
(5)2Cu + 8NH3 + O2 + 2H2O === 2Cu(NH3)42+ + 4OH-
知识点
邻羟基桂皮酸是合成香精的重要原料,下为合成邻羟基桂皮酸的路线之一:
试回答下列问题:
(1)化合物Ⅰ的名称是 ;化合物II→化合物III 的有机反应类型: ;
(2)化合物III 在银氨溶液中发生反应化学方程式: ;
(3)有机物 X 为化合物IV的同分异构体,且知有机物X 有如下特点:
①苯环上的氢有两种,②能与NaHCO3 反应放出气体,③能发生银镜反应。
请写出两种化合物X的结构简式_____________________、___________________________
(4)下列说法正确的是 ;
a.化合物I遇氯化铁溶液呈紫色
b.化合物II能与NaHCO3溶液反应
c.1mol化合物IV完全燃烧消耗 9.5molO2
d.1mol化合物III最多能与3 molH2 反应
(5)有机物R(C9H9ClO3)经过反应也可制得化合物IV,则 R 在NaOH 醇溶液中反应的化学方程式为 。
正确答案
(1)邻羟基苯甲醛;消去反应(2 分)
(2)
(3 分)
(3)
(每个2分,共4分)
(4)a 、c (4 分)
(5)
(3 分)
或
解析
略
知识点
对于可逆反应H2(g)+I2(g)≒2HI(g),在温度一定下由H2(g)和I2(g)开始反应,下列说法正确的是
正确答案
解析
A选项中,速率之比等于计量数之比,应为1:2;B选项出现的净速率在中学没出现过,但根据平均速率的求算,为反应物的净减少量,该项正确;C项明显错误,反应过程中,正反应速率是减小的过程,而逆反应速率是增大的过程;D选项是平衡定义中来,正确。
知识点
往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图像是(气体的溶解忽略不计)
正确答案
解析
略
知识点
扫码查看完整答案与解析





















