- 含氮物质的综合应用
- 共7题
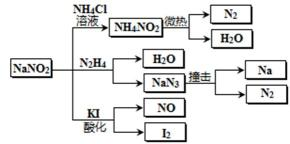
13. 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,物理性质与NaCl极为相似。相关化学性质如下图所示,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28. NO2压缩成N2O4可作火箭燃料中的氧化剂,也可制备硝化试剂N2O5等。
(1)火箭燃料燃烧反应如下:
2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)
若1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则该反应的△H = ____________kJ·mol-1。
(2)在2 L密闭容器内,投入一定量NO2,发生下列反应:2NO2(g)
①不能说明该反应已达到平衡状态的是________________(填字母)。
a.v正(NO2)=2v逆(O2)
b.c(NO2)= c(NO)
c.气体总压不变
d.NO的体积分数保持不变
②下列说法正确的是______________(填字母)。
a.三个实验开始投入的NO2的物质的量均为1.0 mol
b.实验Ⅱ和实验Ⅰ相比,可能隐含的条件是:实验Ⅱ使用了效率更高的催化剂
c.该反应是放热反应
d.实验Ⅰ条件下反应的平衡常数大于实验Ⅲ条件下反应的平衡常数
e.800℃时,该反应的平衡常数为0.25
f.该反应的△S>0,故该反应一定是自发反应
③实验Ⅱ从反应开始到刚达到平衡时,v(O2)=( )mol·L-1·min-1;若再向该2 L密闭容器中通入1 mol NO2、1 mol NO、0.5 mol O2,则平衡将( )移动(填“向右”、“向左”或“不”)。
(3)利用NO2或N2O4可制备N2O5,原理如下图所示。N2O5在电解池的_____________
(填“阴极”或“阳极”)区生成,其电极反应式为( )。
正确答案
(1)-1224.96
(2)①b ②be ③0.0125 向左
(3)阳极 N2O4+2HNO3-2e-=2N2O5+2H+
解析
解析已在路上飞奔,马上就到!
知识点
氮元素可以形成多种化合物。
回答以下问题:
(1)基态氮原子的价电子排布式是_________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是____________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是_______________;N2H4分子中氮原子轨道的杂化类型是___________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) △H=-1038.7kJ·mol-1
若该反应中有4mol N-H键断裂,则形成的π键有________mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在__________(填标号)
a. 离子键 b. 共价键 c. 配位键 d. 范德华力
(4)图1表示某种含氮有机化合物的结构,其分子内4个
氮原子分别位于正四面体的4个顶点(见图2),分子内存
在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a. CF4 b. CH4 c. NH4+ d. H2O
正确答案
见解析。
解析
(1)基态氮原子的价电子排布式是2s22p3 ,学生可能审题时没注意到是价电子排布式。
(2)C、N、O三种元素第一电离能从大到小的顺序是N>O>C
(3)①NH3分子的空间构型是三角锥型,NH3中氮原子轨道的杂化类型是sp3,而肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的,所以N2H4分子中氮原子轨道的杂化类型是sp3,这个与H2O,H2O2中O的杂化类型都是sp3的道理是一样的。
②反应中有4mol N-H键断裂,即有1molN2H4参加反应,生成1.5molN2,则形成的π键有3mol。
③N2H6SO4晶体类型与硫酸铵相同,可见它是离子晶体,晶体内肯定不存在范德华力。
(4)要形成氢键,就要掌握形成氢键的条件:一是要有H原子,二是要电负性比较强,半径比较小的原子比如F,O,N等构成的分子间形成的特殊的分子间作用力。符合这样的选项就是c和d,但题中要求形成4个氢键,氢键具有饱和性,这样只有选c。
知识点
研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标,目前液氨被人们视为一种潜在的清洁燃料。液氨燃烧的化学反应方程式为:4NH3 + 3O2→ 2N2 + 6H2O,和氢燃料相比有关数据见下表,据此判断正确的是
① 以氨和氢为燃料时,可以减缓温室效应
② 氨泄漏到空气中比氢气更易发生爆炸
③ 等质量的氨和氢分别燃烧,氢放出的热量多
④ 氮的液化比氢容易得多
正确答案
解析
以NH3和H2为燃料,反应的产物只有N2 和H2O,没有温室气体CO2产生,因此不会加剧温室效应;由题给有关数据可推知,NH3比H2易液化,也易贮存。
知识点
下列说法错误的是
正确答案
解析
略。
知识点
已知HCN是一种无色剧毒气体,遇皮肤或通过呼吸道吸入均会造成严重的中毒或死亡,HCN遇明火或强灯光均会易燃或易爆.它的水溶液是一种极弱的易挥发酸,结合以上信息,下列说法你论为错误的是
正确答案
解析
A:HCN具有还原性,漂白粉具有氧化性,加入足量石灰和漂白粉,可将HCN氧化为无毒物质,故A正确;B:由题给信息可知检查HCN外溢时,必须避免皮肤接触以及爆炸等事故,应穿特制防护服,并用特制的手电筒,故B正确;C:冶金废水不能直接排放,含有的HCN会严重污染水源,故C错误;D:在通风橱中进行,可防止中毒,故D正确。故选C。
知识点
8.下列关于自然界中氮循环(如右图)的说法不正确的是:( )
正确答案
解析

知识点
扫码查看完整答案与解析