- 烃的衍生物
- 共165题
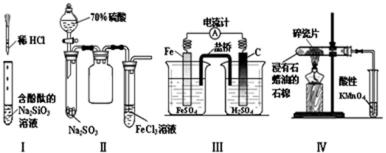
13.对实验Ⅰ~Ⅳ的实验现象预测正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.工业上消除氮氧化物的污染,可用如下反应:

在温度T1和T2时,分别将0.50molCH4和1.2molNO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.以NA表示阿伏加德罗常数,下列说法错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
4.组成和结构可用
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.常温下,将10 mL 0.2 mol/L的一元酸HA与V mL等浓度的NaOH溶液混合。当V=10 mL时,所得溶液中部分微粒组成及浓度如图所示。假设溶液体积可以相加,则下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
下列有关香叶醇的叙述正确的是()
正确答案
解析
由该有机物的结构式可以看出:
B错误,因为香叶醇有双键,可以使溴的四氯化碳溶液褪色
C错误,因为香叶醇有双键、醇羟基,可以使高锰酸钾溶液褪色
D错误,香叶醇有醇羟基,可以发生酯化反应(取代反应的一种)
知识点
下列说法正确的是
正确答案
解析
A选项:实验室从海带提取单质碘缺少了氧化过程,萃取后还要分液。B选项:用乙醇和浓H2SO4制备乙烯时必须使温度迅速提高至约170℃,不可能是水浴加热(水浴加热温度最高只能达到100℃)。D选项:蛋白质溶液中加入饱和(NH4)2SO4溶液发生盐析(盐析是可逆过程,不破坏蛋白质的生理活性,加水后又溶解),蛋白质溶液中加入CuSO4等重金属盐溶液变性析出(变性是不可逆过程,蛋白质失去了生理活性,加水不再溶解)。C选项:通常认为是Cl—替换氧化铝中的O2—而形成可溶性的氯化物,所以铝表面的氧化膜易被Cl—破坏。
知识点
科研、生产中常涉及钠、硫及其化合物。
(1)实验室可用无水乙醇处理少量残留的金属钠,化学反应方程式为_______。要清洗附着在试管壁上的硫,可用的试剂是_______。
(2)下图为钠硫高能电池的结构示意图,该电池的工作温度为320℃左右,电池反应为2Na+
(3) Na2S溶液中离子浓度由大到小的顺序为_______,向该溶液中加入少量固体CuSO4,溶液pH_______(填“增大”“减小”或“不变”), Na2S溶液长期放置有硫析出,原因为_______(用离子方程式表示)。
正确答案
(1)2CH3CH2OH + 2Na
(2)xS+2e- = Sx2- ;离子导电(导电或电解质)和隔离钠与硫;4.5
(3)c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);减小;2S2-+ 2H2O+O2=2S+ 4OH-
解析
(1)乙醇与钠反应的方程式为:2CH3CH2OH + 2Na
(2)正极上是S得到电子发生还原反应:xS+2e- = Sx2-;要形成闭合回路,M必须是能使离子在其中定向移动的,故M的两个作用是导电和隔膜;假设消耗的质量都是207 g,则铅蓄电池能提供的电子为2 mol,而钠硫电池提供的电子为
(3) Na2S溶液中,存在的水解反应为:H2O + S2- 

知识点
27.甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过反应Ⅰ和Ⅱ来制备甲醇。
⑴将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积
为100L),在一定条件下发生反应:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析