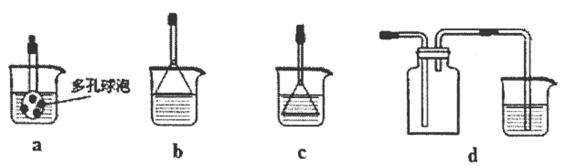- 纯碱工业(侯氏制碱法)
- 共12题
与索尔维制碱法相比,侯德榜制碱法最突出的优点是
正确答案
解析
略
知识点
(1)下列叙述正确的是________。
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为
B. 海水提镁的主要步骤为
C. 普通水泥的主要成分是硅酸钙
D. 黏土的主要成分是三氧化二铝
(2)工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为________;
②硫酸钠和焦炭、石灰石反应的化学方程式为________(已知产物之一为CaS);
2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
①图中的中间产物C是________,D________。(写化学式);
②装置乙中发生反应的化学方程式为________;
3)联合制碱法对氨碱法的改进,其优点是________;
4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?________。
正确答案
(1)AC
(2)1)①2NaCl+H2SO4(浓)


解析
(1)A为接触法制硫酸的基本原理;B镁工业先期加入的是石灰不是石灰石,后期电解的也不是氯化镁溶液;C普通水泥的成分为硅酸二钙、硅酸三钙、铝酸三钙,说主要成分是硅酸钙正确;黏土的主要成分是二氧化硅,还有氧化镁、碳酸钙和三氧化二铝。(2)1)是考查工业生产中的基本原理;2)是生产过程中工艺的考查,在细读生产工艺图中各物质的变化后,可得出;3)考查对教材知识的掌握情况;4)分析图可看出NaHCO3与新信息KHCO3在溶解度图中的差别,可推测溶解度的差别是判断的依据。
知识点
下列化学工业中,未涉及原料循环使用的是
正确答案
解析
略
知识点
下图模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
正确答案
解析
略
知识点
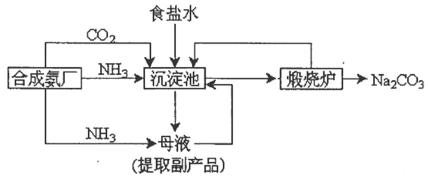
根据侯德榜提出的工艺,制碱厂设计生产流程如下:
(1)该流程中可循环利用的物质是_________。向母液中通氨气,并加入细小食盐颗粒,冷却析出副产品,通氨气的作用有_________。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)检验产品纯碱中是否含有NaCl的试剂是_________。
(3)某学习小组在实验室模拟制碱有关工艺。
①若利用氯化铵和熟石灰制取氨气,反应方程式是_________,制得的氨气可用下列盛有NaCl溶液的_________装置吸收。
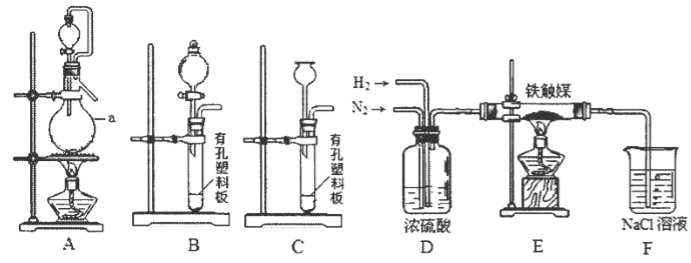
②已知用饱和NaNO2与NH4C1溶液加热可制取氮气。该小组模拟工业合成氨设计如下装置:
仪器a的名称是_________;氢气的发生装置应选用_________;A装置加热片刻后,即应移去酒精灯以防反应物冲出,其原因是_________。装置D的作用是①除去N2、H2中的水;②_________;③观察并调节气泡速率,控制N2、H2的比例。
有同学认为:从氨合成器(E装置)中出来的气体连续通入F装置的NaCl溶液中,可能会发生倒吸。你认为是否可能并说明理由_________。
正确答案
(1)CO2、NaCl(溶液);AC
(2)AgNO3溶液、HNO3溶液
(3)①2NH4Cl + Ca(OH)2 
解析
略。
知识点
扫码查看完整答案与解析