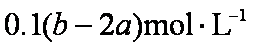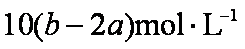- 化学综合计算
- 共266题
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠___g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
(i)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
(ii)计算并确定该钠-钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
正确答案
见解析。
解析
(1) 78 ;
(2)
(i)c(OH-)=
(ii)设上述合金中含amolNa、bmolK, a+b=0.75×2 23a+39b=5.05
a=0.050mol b=0.10mol,该钠-钾合金化学式为NaK2
(3)溶液含NaOH,NaOH与CO2反应生成的Na2CO3:15-
112LCO2的物质的量:112/22.4=5(mol) n[Al(OH)3]:n(Na2CO3)=[(5-3)×2]:5=4:5。
(4)由NaCl质量推算,氢氧化钠样品摩尔质量为:
M1(NaOH)=
M2(NaOH)=
M2(NaOH)=
结论:实验①所取氢氧化钠样品是NaOH;实验②和③所取氢氧化钠样品应该是NaOH·H2O。
本题以元素化合物为载体命题,意在考查考生的计算能力和分析、推理能力。
(1)利用“N”守恒可知需m(NaN3)=(40.32L/22.4L·mol-1)×2/3×65g·mol-1=78g。
(2)①由反应方程式可知产生1molH2同时生成2molOH-,故c(OH-)=(0.075mol×2)/0.2L=0.75mol/L;②设合金中Na、K的物质的量分别为amol、bmol,然后利用质量守恒与得失电子守恒可得方程式:a+b=0.75×2 和23a+39b=5.05,解之得a=0.050mol、b=0.10mol,故可得到合金的化学式为NaK2。
(3)若溶液中仅含NaAl(OH)4,利用方程式可知得到24molAl(OH)3的同时生成12molNa2CO3,而实际得到24molAl(OH)3与15molNa2CO3,说明溶液中含有NaOH,且NaOH优先与CO2反应生成Na2CO3,利用Na守恒知溶液中n(NaOH)=(15-12)mol×2=6mol,故通入112LCO2(5mol)先与NaOH作用消耗CO23mol生成3mol Na2CO3,然后2molCO2与NaAl(OH)4作用得到4molAl(OH)3和2mol Na2CO3,故生成n[Al(OH)3]:n(Na2CO3)=4:(3+2)=4:5。
(4)由NaOH+HCl=NaCl+H2O可知溶液PH=7时,二者恰好反应,故三次实验得到的固体均为纯净的氯化钠,故利用“钠守恒”得m(NaCl)/M(NaCl)=m(氢氧化钠样品)/M(氢氧化钠样品),利用该式和题中数据可计算出三次实验中所取氢氧化钠样品的摩尔质量,进而可得出结论。
知识点
标准状况下2.24LH2和Cl2组成的混合气体,经光照后缓缓通入100ml 1mol/LNaOH溶液中充分反应,测得最终溶液中NaClO的浓度为0.1mol/L(假设溶液体积不变,且不考虑水解),则原混合气体中Cl2的体积分数为 …
正确答案
解析
略
知识点
把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
正确答案
解析
a mol Na2SO4与BaCl2反应生成a mol BaSO4,则说明一份中含BaCl2 a mol ;b mol AgNO34与BaCl2和KCl反应会生成b mol AgCl,说明一份中总的Cl-为 b mol;而a mol BaCl2中含Cl-为2a mol,则一份中含KCl为(b-2a)mol,由于原溶液为5等份,应含KCl为5(b-2a)mol。故该混合溶液中钾离子浓度为5(b-2a) mol/0.5L=10(b-2a) mol/L。
知识点
你认为下列数据可信的是
正确答案
解析
略
知识点
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
正确答案
解析
本题考查基本概念。考生只要对基本概念熟悉,严格按照基本概念来做,弄清质量分数与物质的量浓度及密度等之间的转化关系即可。
知识点
等浓度的下列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇,它们的pH由小到大排列正确的是
正确答案
解析
依据酸性强弱的大小顺序:乙酸>碳酸>苯酚>乙醇,知D项正确。
知识点
把VL含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
正确答案
解析
由离子反应方程式Mg2++2OH-=Mg(OH)2↓和Ba2++SO42-=BaSO4↓可知Mg2+和SO42-的物质的量分别为0.5amol和bmol,忽略溶液中的H+和OH-由电荷守恒知溶液中K+的物质的量为(b-0.5a)×2mol=(2b-a)mol。由于混合溶液分成两等份,所以选项C是错误的,正确的选项应该是D。
知识点




正确答案
解析
略
知识点
足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、N
正确答案
解析
略
知识点
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是
正确答案
解析
A. 设Cu Xg, Mg Yg,X+Y=1.52,X/64×98+Y/24×58=2.54,得X=0.02 Y=0.01
B. c(HNO3)=1000Ρɯ/M=1000×1.40×63/63=14.0mol/L
C. nHNO3=14.0×0.05=0.7mol=nNO2+2nN2O4,nNO2+N2O4=1.12L/22.4L/mol, nNO2=0.04 mol nN2O4=0.01 mol,可知C正确
D. 与硝酸反应的NaOH nNaOH=0.7-0.04-0.02=0.64,与金属离子反应的NaOH nNaOH=0.06,总NaOH的量 n总=0.64+0.06=0.7 mol,故需要NaOH 700 mL
知识点
扫码查看完整答案与解析