- 化学综合计算
- 共266题
ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有 性。
(2)工业上可以通过下列方法制取ClO2,请完成该反应化学方程式:
2KClO3+ SO2 = 2ClO2 + 。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ. 取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ. 加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2 ═ S4O62-+2I-)
Ⅲ. 加硫酸调节水样pH至1~3。
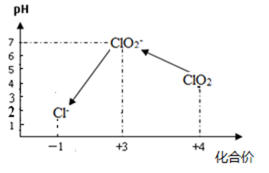
操作时,不同pH环境中粒子种类如下图所示:
请回答:
① 操作Ⅰ中反应的离子方程式是 。
② 确定操作Ⅱ完全反应的现象是 。
③ 在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是 。
④ 若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3 mol/L 的Na2S2O3溶液10mL,则水样中ClO2的浓度是 mg/L。
正确答案
见解析。
解析
(1)氧化
(2)K2SO4
(3)
① 2ClO2+2I- =2ClO2-+I2
② 蓝色消失,半分钟内不变色
③ ClO2-+4I- +4H+=Cl-+2I2+2H2O
④ 0.675
知识点
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)。
(1)甲烷与水蒸气反应,被氧化的元素是________,当生成标准状况下35.84L合成气时转移电子的物质的量是________。
(2)将2 mol CH4和5 mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度、压强的关系如图。
①达到A点所需的时间为5min,则v(H2)=________,100℃时平衡常数K=________。
②图中的P1________P2(填“<”、“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是________。
(3)合成气用于合成氨气时需除去CO,发生反应CO(g)+H2O(g)=CO2(g)+H2(g) 

A.降低温度
B.恒温恒容下充入He(g)
C.将H2从体系中分离
D.再通入一定量的水蒸气
可用碳酸钾溶液吸收生成的CO2,常温下pH=10的碳酸钾溶液中水电离的OH-的物质的量浓度为________,常温下,0.1 mol·L-1KHCO3溶液pH>8,则溶液中c(H2CO3)________c(CO32-)(填“>”、“=”或“<”)。
正确答案
(1)C(碳);2.4mol
(2)①0.006mol·L-1·min-1;75×10-4 mol2·L-2;② < ;KC >KB> KA
(3)AC;1×10-4 mol·L-1;>
解析
略。
知识点
下列说法正确的是
正确答案
解析
略
知识点
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)汽车尾气的大量排放是造成雾霾、酸雨、光化学烟雾的重要因素,发展燃料电池汽车可以有效地解决上述问题。直接甲醇燃料电池(DMFC)不会产生有害产物,能量转换效率比内燃机要高2~3倍,电池结构如图所示,c处通入的物质为_______外电路中电子从_______到_______(填“A”或“B”)移动。写出电池负极的电极反应方程式_______。
(2)工业废水中常含有一定量的Cr2O72-,它们会对人类及生态系统产生很大损害,电解法是处理铬污染的常用方法。该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3、Fe(OH)3沉淀。
①反应中,1mol的Cr2O72-生成沉淀,外电路通过电子的物质的量为_______mol。
②在阴极发生的电极反应方程式_______。
③常温下,Cr(OH)3的溶度积Ksp=10-32,溶液应调至pH=_______才能将废液排放。(Cr3+浓度小于10-5mol/L时,可认为完全除去)
(3)已知某温度下,H2CO3电离平衡常数Kl=8.5×10-7、K2=1.0×10-10。某碱性溶液中,经测定含有浓度较高的碳酸钠,向溶液中加入少量NaOH固体,[OH-]/[CO32-]_______(填“增大”“减小”或“不变”),该温度下,0.01mol/L的Na2CO3溶液中c(OH-)=_______mol·L -1(只考虑第一步水解,不要求精确计算)。
正确答案
(1) O2;A到B;CH3OH-6e-+H2O=CO2+6H+
(2) 12;2H++2e-=H2;5
(3) 增大;0.001
解析
略。
知识点
硫元素价态众多,可与卤素、氮等元素化合形成许多复杂化合物,在科学技术和生成中有重要的应用。根据题意完成下列计算:
(1) 由硫与限量氯气在50~60°C反应16~20小时,可恰好完全反应,得到两种硫的氯化物A和B。A物质中的含硫量为0.131,B物质中的含氯量为0.816,A的相对分子质量比B大71。计算确定这两种氯化物的分子式分别为 _____________ 。
若上述反应得到的A、B的物质的量比为3:2,则参加反应的S和氯气的物质的量之比为___________。
(2)硫的卤化物或卤氧化物都有强水解性,可以作脱水剂。SF4吸收V mL液态水(4℃),完全反应,得到3.2gSO2气体(假设SO2完全逸出)和10%的酸溶液,计算吸收的液态水的体积V为 ___________mL。
(3) S4N4是亮橙色固体,不溶于水和有机溶剂,是一种重要的金属有机化学反应物。一般用S2Cl2、SCl2的惰性溶剂(CS2)氨解制得:
6S2Cl2+16NH3→S4N4+S8+12NH4Cl;
24SCl2+64NH3→4S4N4+S8+48NH4Cl。
S2Cl2、SCl2的混合液体52.86g溶于足量的CS2中,再通入35.84L氨气(标准状况)完全氨解,产生14.080g硫单质。剩余氨气用40g水完全吸收形成氨水(密度为0.923g/mL)。
计算:①该混合液体中S2Cl2、SCl2的物质的量之比为 __________- 。
②所得氨水的物质的量浓度为 ___________- (保留1位小数)。
(4) S4N4与Ag在一定条件下反应,失去N2而缩合成(SN)x,(SN)x合成于1910年,过了五十年,才发现它在0.26K的低温下,可转变为超导体(superconductor)。(SN)x的结构式为:
已知1.20×105 mol S4N4与Ag发生缩合,失去了1.20×105 mol N2,生成二百聚物[(SN)200]和三百聚物。测得缩合产物中二百聚物的质量分数为0.50。
计算:①缩合产物中各缩合物的物质的量。
②若Ag的实际使用量为8.64kg,求Ag的循环使用次数。
正确答案
(1)A:SCl6; B: SCl4 ;5:13
(2)37.8
(3)5:2 (2分)9.2 mol/L
(4)二百聚物:600mol;三百聚物:400mol。
6000次
解析
略
知识点
已知:硝酸铜受热易分解。
170℃时,2Cu (NO3)2


(其中2NO2→N2O4,2NO2

800℃时,4CuO

(1)取5.64g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是 (填分子式),体积(标准状况)为 ;
将吸收液加水稀释到100mL,此溶液中
(2),取5.64g无水硝酸铜加热至某温度分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是 。
实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O

(3),取8.00g CuO,加热到1800℃左右,冷却后称得质量为6.88g,通过计算求出反应后剩余固体中各成分的物质的量之比。
(4)取8.00g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中
n (Cu2O)





充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
正确答案
(1)O2,0.168L,0.6mol/L
(2)3.48g或2.32g
(3)n(Cu2O):n(Cu)=3:4
(4)nCuO=0.1—(y+2xy)/64(1+x)
解析
略
知识点
下列说法一定正确的是
正确答案
解析
略。
知识点
镁、铝、铁及其化合物在生产和生活中有广泛的应用。
(1) 镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg):n(Al)=______________。
(2)铁矿石的主要成分是FeS2(假设杂质只含有SiO2)是生产硫酸的原料。取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应)。该硫铁矿中FeS2的质量分数为______________。
(3) 现有一定量的铁粉和铝粉组成的混合物跟100 mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00 mol·L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):
纵坐标中A点的数值是 ______ 。
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比_______ (最简单的整数比)
②再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
则该硫酸溶液的物质的量浓度____ 。
③若在实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少? (写出必要的步骤,答案保留3位小数)
正确答案
(1)1:3
(2)78%
(3)00.856
(4)
① 50:1
②1.25mol/l
③H2SO4共0.125 mol,设再加入钢样的质量为m时酸反应完,则有:
n(Fe)总= (5.624 g + m)×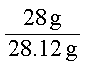
a.若加入的钢样粉末过量(m≥1.406 g),H2SO4全反应,则:
m(余固体) = (5.624 g + m g)-0.125 mol×56 g·mol-1 = (m-1.376)g。
b.若加入的钢样粉末少量(m≤1.406 g),Fe全溶解,
则:m(余固体) = (5.624 g + m g)×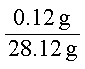
解析
略
知识点
硫的化合物在生产和科研中发挥着重要作用。
(1)SO2Cl2常用于制造医药品、染料、表面活性剂等。已知:
SO2Cl2(g)
某温度时向体积为1 L的恒容密闭容器中充入0. 20mol SO2Cl2,达到平衡时,容器中含0.18mol SO2,则此过程反应吸收的热量为________kJ,该温度时反应的平衡常数为________。将上述所得混合气体溶于足量BaCl2溶液中,最终生成沉淀的质量为________。
(2)工业上制备硫酸的过程中存在反应:
2SO2(g)+O2(g) 
400℃,1.01×105Pa,向容积为2L的恒容密闭容器中充入一定量 SO2和O2,n(SO3)和n(O2)随时间的变化曲线如图所示。
①0~20min反应的平均速率υ(O2)=________。
②下列叙述正确的是________。
a. A点υ正(SO2) >υ逆(SO2)
b. B点处于平衡状态
c. C点和D点n(SO2)相同
d. 其它条件不变,500℃时反应达平衡,n(SO3)比图中D点的值大
(3)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,当溶液pH约为6时,Na2SO3溶液吸收SO2的能力显著下降,应更换吸收剂。此时溶液中c (SO32-)的浓度是0.2 mol·L-1,则溶液中c(HSO3-)是________mol·L-1。
正确答案
(1)17.5;1.62;46.6g
(2)0.02mol/(L·min);ac;1.6mol·L-1
解析
略。
知识点
取500mL Na2CO3溶液与300mL 1 mol·L-1盐酸反应,在不断搅拌下将碳酸钠溶液逐滴滴入盐酸中与将盐酸逐滴滴入碳酸钠溶液中,所产生气体的物质的量之比为3 : 2 。则碳酸钠溶液的物质的量浓度为
正确答案
解析
略
知识点
扫码查看完整答案与解析