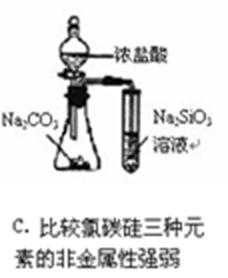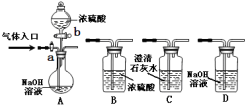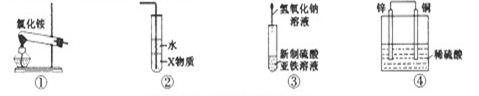- 化学实验基本操作
- 共73题
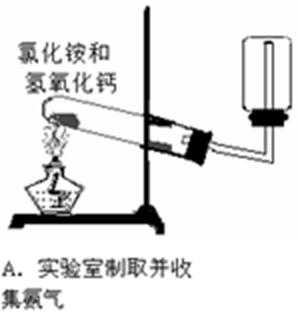
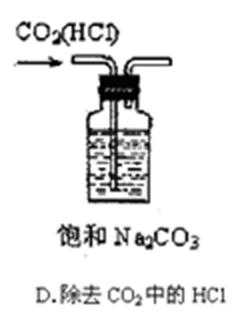
4.下列关于甲、乙、丙、丁四组仪器装置的有关用法正确且能达到目的的是( )
正确答案
解析
解:A.二氧化硫和水反应生成亚硫酸,亚硫酸酸性大于硅酸,所以二氧化硫能和硅酸钠反应生成硅酸,但亚硫酸不是S元素最高价氧化物的水化物,所以不能据此判断S、Si的非金属性强弱,故A错误;
B.酸应该加在酸式滴定管中。
C. 固体溶质不能在容量瓶中溶解,C项不正确.
D.NO不溶于水,可以采用排水法收集,如果该集气瓶中装满水,导气管遵循“短进长出”原则,故D正确;
考查方向
解题思路
该题的易错选项是A
关于广口瓶在实验中的多功能应用总结如下:
A装置可作集气瓶和洗气瓶,例如,利用A装置收集或干燥以下三种气体。①Cl2 ②NH3 ③NO(答案均填序号)
Ⅰ.若集气瓶是干燥的,则由b口进气可收集气体②。
Ⅱ.若集气瓶是干燥的,则由a口进气可收集气体①。
Ⅲ.若集气
Ⅳ.若集气瓶内装入浓硫酸进行气体干燥,气体由a口进入,可用此装置干燥的气体是①③。
易错点
1、非金属性强弱判断、气体收集等知识点。
2、明确实验原理是解本题关键,会从装置的评价性、操作的规范性判断,题目难度中等。
知识点
化工厂铬渣中含有Na2SO4及少量Cr2O72-、Fe3+,下面是从铬渣提取Na2SO4和利用副产品制取FeCl3的工艺流程。已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol•L-1)时pH分别为3.6和5。
(1)①操作C加硫酸酸化而不选用盐酸的原因是________。
②酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为________。
③根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为________(填字母序号)。
A. 蒸发浓缩,冷却结晶,过滤
B. 蒸发浓缩,趁热过滤
④温度相同时Ksp[Cr(OH)3]________Ksp[Fe(OH)3](填“>”或“<”)
(2)已知FeCl3从溶液中析出的是FeCl3•6H2O,在空气中直接加热FeCl3•6H2O晶体得不到纯的无水FeCl3,原因是________(用化学方程式表示)。由FeCl3•6H2O晶体得到纯的无水FeCl3的合理方法是________。
(3)下图所示仪器可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是________。
A. a—b—c—d—e—e—f—g—h
B. a—c—b—d—e—h—i—f
C. a—d—e—c—b—h—i—g
D. a—e—d—c—b—h—i—g
若以KMnO4和浓盐酸为原料来制取Cl2,并希望能控制反应速率,下列最适合的装置是________(已知:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2
正确答案
(1)①酸性环境Cl-被Cr2O72-氧化生成Cl2污染环境,引入NaCl杂质导致产品不纯;②3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;③B;④>
(2)FeCl3•6H2O
(3) D;④
解析
略。
知识点
亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
已知:① NO+NO2+2OH-=2NO2-+H2O
② 气体液化的温度:NO2 21℃ 、 NO –152℃
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A 、 C 、 、 、
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是 。
(3)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是 。
②装置E的作用是 。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为 。
如果没有装置C,对实验结论造成的影响是 。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是 。
正确答案
见解析。
解析
(1) E 、 D 、 B
(2) 防止可能生成的NO被完全氧化成NO2 ,造成对A中反应气体产物检验不完全
(3)① D中出现红棕色气体 ② 冷凝使NO2完全液化
(4) 4NO2 + O2 + 4NaOH = 4NaNO3 +2 H2O
水蒸气存在,会与NO2反应产生NO,造成对NO来源于哪里的认识不清
(5) 2NaNO2 + H2SO4 = Na2SO4 + NO2↑ + NO↑+ H2O
知识点
9.下列实验中,能够达到实验目的的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
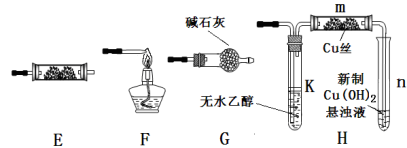
29.下图为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去,已知乙醇的沸点为78.5℃),请根据要求完成下列问题(仪器装置可任意选用,必要时可重复选择,a、b为旋钮)。
(1)若A中气体入口通入CO和CO2的混合气体,E内放置CuO,欲得到纯净干燥的CO,并验证其还原性及氧化产物,所选装置的连接顺序为( )(填写装置代号)。能验证CO氧化产物的实验现象是( )。
(2)完成(1)实验后,将A中a旋钮关闭,并在E内放置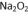
①为获得氧气,关闭a旋钮后,首先需进行的操作是( )。
②为得到平稳的乙醇蒸气流,提高反应效率,可采取的措施是(用文字简述)( );m中发生反应的化学方程式是( )。
③若想观察到试管n中有红色沉淀出现,还需要进行的操作是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.关于下列各装置图的叙述中,正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.某研究性学习小组将一定浓度的Na2C03溶液滴入CuS04溶液中得到蓝色沉淀。甲同学认为只生成CuC03一种沉淀;乙同学认为这两者水解反应相互促进,生成Cu(OH)2一种沉淀;丙同学认为生成CuC03和Cu(OH)2两种沉淀。(查阅资料知:CuC03和Cu(OH)2均不带结晶水)
(1)按照乙同学的理解Na2C03溶液和CuS04溶液发生反应的离子方程式为:
(2)甲同学用下图所示装置设计实验,选择必要的试剂,对生成物的成分的进行定性探究。
①在探究沉淀物成分前,须将沉淀从溶液中分离并洗涤、干燥。
②各装置连接顺序为 ( ) →( ) → ( ) 。(填装置字母代号)
③装置C中装有试剂的名称是( )。
④能证明生成物中只有CuC03的实验现象是( )。
(3)若CuC03和Cu(OH)2两者都有,丙同学通过下图所示装置进行定量分析来测定其组成。
①装置E中碱石灰的作用是( )
②实验过程中需要经历以下三个步骤的操作:
a.关闭K1、K3,打开K2、K4,充分反应
b. 打开K1、K4,关闭K2、K3,通入过量空气
c. 打开K1、K3,关闭K2、K4,通入过嚣空气
正确的顺序是(填选项序号)( )
③若沉淀样品的质量为mg,装置D的质量增加了ng,则沉淀中CuC03的质量分数为( )
正确答案
(1)
(2)②A→C→B ③无水硫酸铜 ④装置B中澄清石灰水变浑,装置C中无水硫酸铜不变色 (3)①防止空气中CO2和水蒸气进入装置D
②c a b (3分,顺序错不给分) ③
解析
解析已在路上飞奔,马上就到!
知识点
28.
(Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接: _______→_______→ _______(填字母编号)。
②选择所需的试剂: _______(填字母编号)。
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论:____________。
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下:
已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀I是_________沉淀II是________(填化学式),pH1______pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为__________。
(3)“调节pH为2-3”的目的是 ________;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是____________ 。
正确答案
(Ⅰ)(1)①A--->C--->E; ②b d f ; ③烧瓶中有黄绿色气体生成,试管中溶液由无色变为橙色,可证明Cl2 的氧化性强于Br2,Br-的还原性强于Cl-
(Ⅱ)(1)Fe(OH)3 Al(OH)3 <
(2)漏斗
(3)防止Ni2+水解
(4)2Ni2++ClO—+4OH- ====2NiOOH↓+Cl- +H2O
解析
解析已在路上飞奔,马上就到!
知识点
28.已知2H+ + 2NO2— = NO↑ + NO2↑ + H2O。现用下图所示仪器(夹持装置已省略)及药品,检验亚硝酸钠与硫酸反应生成的气体产物。
★NO和NO2部分性质如下表所示:
(1)为了检验装置A中生成的气体产物,仪器的连接顺序为(从左向右连接):A→
→______→_______→_______;组装好仪器后,接下来进行的操作是( )
(2)打开弹簧夹,通一会儿N2,目的是( )
(3)关闭弹簧夹,打开分液漏斗活塞,滴入70%的硫酸后
①确认A中产生气体含有NO2,依据的现象是_____________________________
②确认A中产生气体含有NO,依据的现象是_____________________________
③装置E的作用是______________________________________________________
(4)如果没有装置C,对实验结论造成的影响是______________________________
(5)工业生产中氮氧化物的排放会造成环境污染,可采用如下方法处理氮氧化物:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.
(1)验证固体W焙烧后产生的气体含有SO2的方法是:________________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。
装置A中发生反应的化学方程式为_________________________________________。
(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_____________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析