- 气体的收集
- 共20题
10.下列实验装置正确且能达到实验目的的是
正确答案
解析
A.标准氢氧化钠溶液应该使用碱式滴定管,错误;
B.硫酸和碳酸钠反应生成二氧化碳,碳酸和硅酸钠反应生成硅酸,能验证H2SO4、H2CO3、H2SiO3酸性的强弱,正确;
C.实验室制备乙酸乙酯时反应温度不宜过高,要保持在60℃~70℃左右,应水浴加热,C错误;
D.比较碳酸钠和碳酸氢钠的热稳定性,碳酸钠放在大试管中,碳酸氢钠放在小试管中,D错误;故选B。
考查方向
解题思路
A.标准氢氧化钠溶液应该使用碱式滴定管;
B.硫酸和碳酸钠反应生成二氧化碳,碳酸和硅酸钠反应生成硅酸;
C.实验室制备乙酸乙酯时反应温度不宜过高,要保持在60℃~70℃左右,应水浴加热;
D.比较碳酸钠和碳酸氢钠的热稳定性,碳酸钠放在大试管中,碳酸氢钠放在小试管中;
易错点
实验室制备乙酸乙酯时反应温度不宜过高,要保持在60℃~70℃左右,应水浴加热
知识点
7.在日常生活中,我们经常看到铁制品生镑、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是 ( )
正确答案
解析
A.具支试管内气体受热压强增大,不能更快更清晰地观察到液柱上升,故A错误;B.负极材料应为铁,故B错误;C.负极电极反应式为Al-3e-=Al 3+,正极反应式O2+4e-+2H2O=4OH-,总反应方程式为:4Al+3O2+6H2O═4Al(OH)3,故C错误;D.负极电极反应式为Al-3e-=Al3+,正极反应式O2+4e-+2H2O=4OH-,总反应方程式为:4Al+3O2+6H2O═4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑,故D正确;
考查方向
解题思路
A.加热更容易使O2逸出,不易发生吸氧腐蚀;
B.负极材料应为铁;
C.根据Cl-的趋向可判断,铝箔表面应为负极,活性炭区为正极,正极:O2+4e-+2H2O=4OH-,负极:Al-3e-+3OH-=Al(OH)3↓,所以C错误,D正确。
易错点
A.不能准确理解吸氧腐蚀的原理和实质;B.不能熟练判断原电池的负极;
C.不能准确理解吸氧腐蚀的原理和实质;
知识点
我国锑的蕴藏量占世界第一位,辉锑矿(Sb2S3)是其主要矿物。某冶金课题组设计的一种提取锑的工艺流程如下图
请回答下列问题:
14.从辉锑矿提取锑的传统工艺是:先现在空气中灼烧辉锑矿粉,然后用热还原法冶炼锑。传统工艺对环境的影响是 ,解决思路是 。
15.隔膜电解三氯化锑的盐酸溶液在阳极获得五氯化锑溶液,阴极获得锑和氢气,宜采用___________交换膜(填“阳离子”、“阴离子”或“质子”)。阳极的电极反应式为 。
16.根据流程图写出“浸出”步骤发生反应的化学方程式 。
17.还原除砷的原理是:在大于4mol·L-1的HCl溶液中,以次磷酸钠(Na3PO2)做还原剂,保持微沸温度,使AsCl3被还原为棕色单质砷沉淀,请配平该反应的化学方程式:__AsCl3+ __Na3PO2 +__HCl +__H2O=__As↓+__H3PO3+__NaCl
18.步骤⑤硫化除铜可选用的试剂为_______________.
正确答案
易导致酸雨 先处理,后排放(或回收利用)
解析
从辉锑矿提取锑的传统工艺是:先现在空气中灼烧辉锑矿粉,然后用热还原法冶炼锑。传统工艺对环境的影响是易导致酸雨,解决思路是先处理,后排放(或回收利用)。
考查方向
解题思路
从辉锑矿提取锑的传统工艺是:先现在空气中灼烧辉锑矿粉,然后用热还原法冶炼锑。传统工艺对环境的影响是易导致酸雨,解决思路是先处理,后排放(或回收利用)。
易错点
原电池和电解池的工作原理及应用的流程图分析。
正确答案
阴离子 Sb3+-2e-=Sb5+
解析
从流程图中可以看出负极失电子生成的金属离子在正极得电子生成金属单质,负极金属为镁,故正极电极反应式为Mg2++2e﹣=Mg;阳极产物为SbCl5,而电解完成后产生金属锑,故阴极反应式为Sb3++3e﹣=Sb
考查方向
解题思路
从流程图中可以看出金属离子化后通过熔盐迁移到正极并与正极金属合金化,说明负极失电子生成的金属离子在正极得电子生成金属单质;阳极产物为SbCl5,而电解完成后产生金属锑,应为Sb3+离子在阴极得电子生成。
易错点
原电池和电解池的工作原理及应用的流程图分析。
正确答案
Sb2S3+3SbCl5=5SbCl3+3S
解析
在浸出步骤中具有氧化性的SbCl5和具有还原性的Sb2S3发生氧化还原反应生成不溶性的S单质和SbCl3,故反应方程式为Sb2S3+3SbCl5=5SbCl3+3S
考查方向
解题思路
根据流程图看出“浸出”步骤辉锑矿与阳极产物SbCl5反应产生不溶物,SbCl5具有氧化性,Sb2S3具有还原性,发生氧化还原反应,在浸出液中含有硫单质,所以氧化产物中有硫。
易错点
原电池和电解池的工作原理及应用的流程图分析。
正确答案
2AsCl3+3Na3PO2+3HCl+3H2O=2As↓+3H3PO3+9NaCl
解析
次磷酸钠(Na3PO2)做还原剂,被氧化为H3PO3,P元素由+1价变为+3价,价态升高2;AsCl3被还原为As单质,As元素由+3价变为0价,价态降低3,所以AsCl3和Na3PO2系数为2:3,根据元素守恒配平化学反应方程式为2AsCl3+3Na3PO2+3HCl+3H2O=2As↓+3H3PO3+9NaCl.
考查方向
解题思路
该反应中AsCl3为氧化剂,被还原为As单质;Na3PO2为还原剂,被氧化为H3PO3;HCl显酸性,提供酸性环境,根据得失电子守恒配平。
易错点
原电池和电解池的工作原理及应用的流程图分析。
正确答案
Na2S(其它合理答案也正确)
解析
步骤⑤硫化除铜可选用的试剂为Na2S生成AsS和CuS。
考查方向
解题思路
步骤⑤硫化除铜可选用的试剂为Na2S生成AsS和CuS。
易错点
原电池和电解池的工作原理及应用的流程图分析。
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1) 在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
1 列收集Cl2的正确装置时 。
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中, 。
(2) 能量之间可以相互转化:点解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
1 完成原电池的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
2 铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
3 甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选 作阳极。
正确答案
见解析
解析
(1)
1 要考虑氯气的密度和尾气的处理选C
②氯气和水反应为可逆反应,所以具有氧化性的含氯粒子是Cl2、HClO、ClO-
③加入适量的NaBr溶液,充分振荡,静置。溶液分层,同时下层液体颜色为橙色。
4 完成原电池的甲装置示意图,并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
5 溶解
6 甲,甲可以保持电流稳定,化学能基本都转化为电能。而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能。
(3)Zn
知识点
下图是实验室制取气体的装置,其中发生装置相同,干燥和集气装置有两套,分别用图1和图2表示。下列选项中正确的是
正确答案
解析
略
知识点
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为___________ 。
(2)加氨水调节溶液的PH范围为___________。
(3)滤渣2 的成分是___________(填化学式)。
(4)煅烧过程存在以下反应:
利用上图装置对煅烧产生的气体进行分步吸收或收集。
①D中收集的气体是___________(填化学式)。
②B中盛放的溶液是___________ (填字母)。
a.NaOH 溶液
b.Na2CO3 溶液
c.稀硫酸
d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:___________ 。
正确答案
见解析。
解析
(1)MgCO3+2H+===Mg2++CO2↑+H2O
(2)2.8<PH<9.4
(3)Fe(OH)3
(4)①CO
② d
③3S+6OH-
知识点
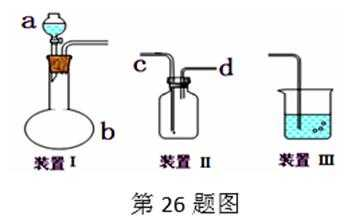
26.化学课外活动小组设计了如图所示的一套气体发生、收集和尾气吸收装置,以探究该装置的多功能性。
(1)甲认为装置Ⅰ可作为实验室快速制氧气的发生器,则装置Ⅰ的b仪器中可加入____,装置Ⅱ从_____管口进气可作为
(2)乙认为利用装置Ⅰ可以制取乙炔,则装置Ⅰ的a仪器中可加入____(写名称),写出实验室制取乙炔的化学方程式: __________________________________
(3)丙认为利用装置Ⅱ,可收集NO,试简述操作方法:_________________。
(4)丁认为利用装置Ⅰ和装置Ⅲ,可验证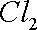
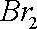
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列实验操作或装置正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.关于下列各装置图的叙述中,不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7. 右图是制取和收集某气体的实验装置,该装置可用于 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析