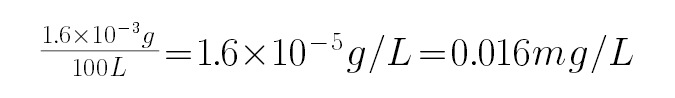- 试纸的使用
- 共3题
空气是人类赖以生存的自然资源。在工业生产上规定,空气中二氧化硫的最大允许排放浓度不得超过0.02mg·L-1。
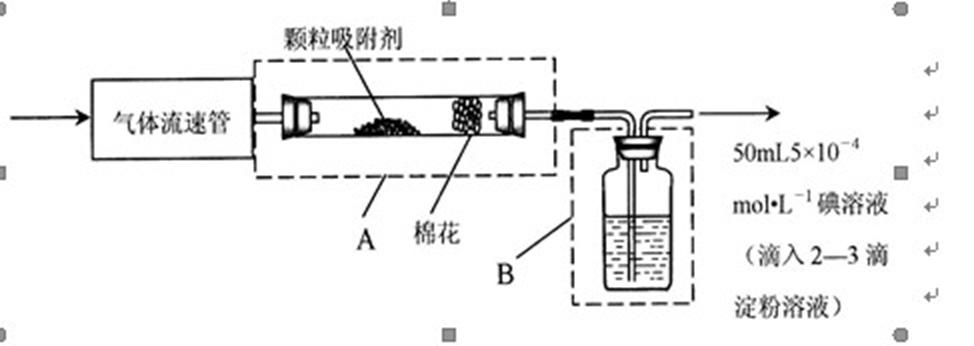
8.为测定某地方空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:
注:气体流速管是用来测量单位时间内通过气体体积的装置①上述实验过程中化学反应的原理是_________(用化学方程式表示)。②应用上述装置测定空气中SO2含量和可吸入颗粒的含量,除测定气体流速(单位:mL· s-1)外,还需要测定碘溶液蓝色褪去所需的时间和_________。③己知:碘单质微溶于水,KI可以增大碘在水中的溶解度。请你协助甲同学完成l00mL5×10-4mo1·L-1碘溶液的配制。为配制精确浓度的溶液,先
要配制1000mLl×10-2 mol·L-1碘溶液,再取5.00mL溶液稀释成为5×10-4mol·L-1碘溶液。
第一步:准确称取_____g碘单质加入烧杯中,同时加入少量碘化钾固体,加适量水搅拌使之完全溶解。
第二步:______,洗涤、定容、摇匀。
第三步:用第二步所得溶液配制5×10-4mo1·L-1碘溶液,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有________(填仪器名称)。
9.空气中SO2含量的测定:①在指定的地点取样,以200mL·s-1气体流速通过气体流速管通入到上图实验装置中,观察记录碘溶液褪色所需时间为500 s,则该地空气中的SO2含量是____mg·L-1,________(填“符合”、“不符合”)排放标准。②如果甲同学用该方法测量空气中SO2的含量时,所测得的数值比实际含量低,其原因可能是___________;___________(假设溶液配制、称量或量取及各种读数均无错误)”。
正确答案
①SO2+I2+2H2O = H2SO4+2HI (2分)②装置A在反应前后的质量。[或吸收前后颗粒吸附剂、棉花、玻璃管(盛放容器)的总质量(2分)] ③2.54(2分);将第一步所得溶液全部转入1000 mL的容量瓶中(1分);移液管(或酸式滴定管) 100mL容量瓶(2分,各1分)
解析
①二氧化硫用碘溶液来吸收,反应的化学方程式为:SO2+I2+2H2O═2HI+H2SO4,
②要测可吸入颗粒的含量,可用颗粒吸附剂来吸收,颗粒吸附剂前后质量之差即为可吸入颗粒的质量,则应测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量,测定SO2含量,除测定气体流速(单位:cm3•min-1)外,还需要测定溶液蓝色恰好褪去所需的时间;
③第一步:为配制精确浓度的溶液,先要配制1000mL l×10-2 mol•L-1碘溶液,再取5.00mL溶液稀释成为5×10-4mol•L-1碘溶液.计算需要称量碘单质的质量=1L×l×10-2 mol•L-1 ×254g/mol=2.54g;
第二步:由题意可知碘单质微溶于水,KI可以增大碘在水中的溶解度,则准确称取2.54g碘单质加入烧杯中,同时还应加入少量碘化钾固体,加适量水搅拌使之完全溶解,则第二步操作应将第一步所得溶液全部转入1000 mL的容量瓶中,定容,摇匀,
则从第二步所得溶液中,取出10.00mL溶液于100mL容量瓶中,加水稀释至刻度线,可得碘溶液;
第三步:用第二步所得溶液配制5×10-4mo1•L-1碘溶液100ml,此步操作中,除烧杯、玻璃棒、胶头滴管外还需要的玻璃仪器有移液管(或酸式滴定管) 100mL容量瓶
考查方向
物质组成的实验探究分析、溶液配制
解题思路
二氧化硫用碘溶液来吸收生产历史和碘化氢,测定SO2含量,除测定气体流速(单位:cm3•min-1)外,还需要测定溶液蓝色恰好褪去所需的时间,要测可吸入颗粒的含量,可用颗粒吸附剂来吸收,颗粒吸附剂前后质量之差即为可吸入颗粒的质量,则应测定吸收前后颗粒吸附剂、棉花、盛放容器的总质量;准确称取碘单质的质量=1L×l×10-2 mol•L-1 ×254g/mol=2.54g,碘单质加入烧杯中,同时还应加入少量碘化钾固体,依据配制100ml溶液的步骤选择需要的玻璃仪器
易错点
溶液的配制步骤完善
教师点评
本题考查了物质组成的实验探究分析、溶液配制过程等知识,掌握基础是解题关键,题目难度中等
正确答案
①0.016(2分);符合(1分) ②气体流速过快,吸收不完全(或未充分反应);(1分)装置气密性较差(1分)
解析
①碘单质物质的量=0.050L×5×10-4mol/L=2.5×10-5mol,
SO2+I2+2H2O=H2SO4+2HI
二氧化硫物质的量为2.5×10-5mol,
质量为2.5×10-5mol×64g/moL=1.6×10-3g,
以200mL•s-1气体流速通过气体流速管通入到上图实验装置中,观察记录碘溶液褪色所需时间为500s,体积=200mL•s-1×500s=100000ml,所以空气中SO2的含量为
,空气中二氧化硫的最大允许排放浓度不得超过0.02mg•L-1,则此气体符合排放标准,
②如果抽气速度过快,部分二氧化硫可能来不及和碘水反应,从而导致测得的数值比实际含量低;吸收不完全测定结果会偏低;如果装置漏气时,部分二氧化硫会逸散出广口瓶,从而导致测得的数值比实际含量低
考查方向
气体含量计算、误差分析
解题思路
①依据化学方程式定量关系计算,SO2+I2+2H2O=H2SO4+2HI;
②如果抽气速度过快,部分二氧化硫可能来不及和碘水反应;如果装置漏气时,部分二氧化硫会逸散出广口瓶
易错点
误差分析
教师点评
本题考查了气体含量计算、误差分析应用等知识,掌握基础是解题关键,题目难度中等
下列检验气体是否收集满所用试纸不恰当的是
正确答案
解析
略
知识点
下列有关实验原理或操作正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析