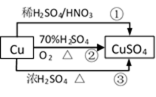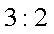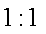- 氧化还原反应的计算
- 共67题
CuSO4是一种重要的化工原料,其有关制备途径如右图所示。下列说法不正确的是( )(已知:2Cu
正确答案
解析
略
知识点
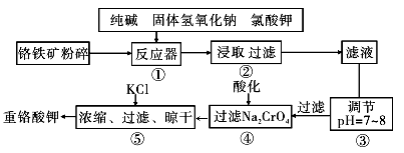
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。涉及的主要反应是: 6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O。
(1)碱浸前将铬铁矿粉碎的目的是________。
(2)步骤③调节pH后过滤得到的滤渣是________。
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式________。
(4)用简要的文字说明操作⑤加入KC1的原因________________。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于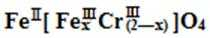
A. x =0.5 ,a =8
B. x =0.5 ,a = 10
C. x = 1.5 ,a =8
D. x = 1.5 ,a = 10
正确答案
(1)增大接触面积,增大反应速率。
(2)Al(OH)3;H2SiO3
(3)2CrO42-+2H+ 
(4)温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应可以得到重铬酸钾。
(5)D
解析
略。
知识点
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程
① 3Fe



② Na2FeO2



③ Na2FeO2



(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,被还原的是 。若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是
A,该生产过程不会产生污染
B,反应③生成的四氧化三铁具有抗腐蚀作用
C,反应①②③均是氧化还原反应
D,反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是: 
正确答案
(1) 6,1,5,3,1,7
(2)Fe 
(3)BD
(4)反应③可逆,氢氧化钠浓度过大,平衡向逆反应方向移动
解析
略
知识点
双氧水可作为采矿业废液的处理剂,如用来消除采矿废液中的氰化物,反应方程式如下:
KCN


正确答案
解析
略
知识点
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu (NO3)2。在所得溶液中加入l.0 mol/L的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。下列有关说法错误的是
正确答案
解析
略
知识点
扫码查看完整答案与解析