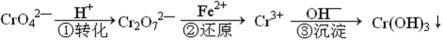- 氧化还原反应的计算
- 共67题
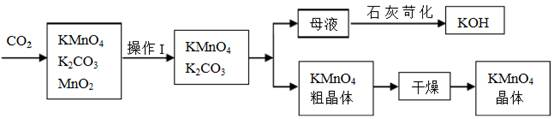
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿(主要成分MnO2)
制备高锰酸钾的一种工艺流程。

(1)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与______相同(填字母)。
a. NaClO溶液
b. 双氧水
c. 苯酚
d. 75%的酒精
(2)操作Ⅰ的名称是_____________;硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生主要反应的化学方程式为 ____________________ 。
(3)上述流程中可以循环使用的物质有__________(填化学式)。若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得__________mol KMnO4。
(4)MnO2在酸性条件下具有强氧化性,可被还原为Mn2+。为验证MnO2具有强氧化性,下列方案可行的是 __________ (填字母)。
A. MnO2固体加入到FeCl3溶液中,再加KSCN溶液,观察溶液是否变红
B.MnO2固体加入到Na2SO3溶液中,再加BaCl2溶液,观察是否有白色沉淀生成
C.MnO2固体加入到FeSO4与KSCN的酸性混合液中,观察溶液是否变红
(5)酸性KMnO4与H2C2O4溶液反应,反应开始时溶液褪色较慢,反应一段时间后褪色会迅速加快,其原因是____________________ 。
正确答案
见解析。
解析
(1)ab
(2)过滤 MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O(2分)
(3)KOH、MnO2 2/3
(4)C
(5)反应中,生成的Mn2+起催化作用
知识点
火法炼铜首先要焙烧黄铜矿,在高温下发生反应:2CuFeS2+O2→Cu2S+2FeS+SO2。下列说法正确的是
正确答案
解析
略
知识点
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入
聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知: 生成氢氧化物沉淀的pH
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂
和氧化剂的物质的量之比是 。
正确答案
见解析。
解析
(1)Fe2O3 + 6H+ = 2Fe3+ + 3H2O
(2)稀硫酸、KMnO4 溶液 (或稀盐酸、K3[Fe(CN)6]溶液)
(3)① 2Fe2+ + ClO- + 2H+ = 2Fe3+ + Cl- + H2O
② pH约为3时,Fe2+不能形成沉淀,将Fe2+氧化为Fe3+,可使铁完全沉淀。
(4)ClO- + Cl- + 2H+ = Cl2 + H2O
(5)浓缩至饱和,冷却结晶
(6)2 : 3
知识点
利用某含铬废液[含较低浓度的Na2Cr2O7、Fe2(SO4)3]制备K2Cr2O7。
流程如下:
Ⅰ.用NaOH溶液调pH至3.6,产生红褐色沉淀,过滤;
Ⅱ.向滤液中加入Na2SO3,一定操作后分离出Na2SO4;
Ⅲ.将分离出Na2SO4后的溶液调pH约为5,得到Cr(OH)3沉淀;
Ⅳ.在KOH存在条件下,向Cr(OH)3中加入足量H2O2溶液,得到黄色溶液;
Ⅴ.向黄色溶液中加入物质A后,溶液变为橙红色,一定操作后得到K2Cr2O7固体;
Ⅵ.测定K2Cr2O7固体的纯度。
已知:Cr2O72-(橙红色)+H2O
(1)步骤Ⅰ中红褐色沉淀的化学式是 。
(2)步骤Ⅱ中加入Na2SO3的目的是 。
(3)步骤Ⅳ中反应的离子方程式是 。
(4)步骤Ⅴ中加入的物质A可以是 。(填序号)
a.KOH
b.K2CO3
c.H2SO4
d.SO2
(5)步骤Ⅵ的操作是:取0.45 g K2Cr2O7产品配成溶液,酸化后滴入18.00 mL
0.50 mol/L的FeSO4溶液,恰好使Cr2O72-完全转化为Cr3+。产品中K2Cr2O7的纯度是 。(注:K2Cr2O7的摩尔质量为294 g/mol)
(6)向橙红色的K2Cr2O7溶液中,滴加Ba(NO3)2溶液,产生黄色沉淀,溶液pH减小。试推测黄色沉淀是 ,溶液pH变小的原因是 。
正确答案
见解析。
解析
(1)Fe(OH)3
(2)将+6价的Cr还原为+3价
(3)2Cr(OH)3+3H2O2+4OH-=2CrO42-+8H2O
(4)c ;
(5)98%
(6)BaCrO4 ;
K2Cr2O7溶液中存在平衡:Cr2O72-(橙红色)+H2O
知识点
4.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是( )
正确答案
解析
略
知识点
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程式为

正确答案
解析
略
知识点
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+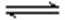
(1) 若平衡体系的pH=2,则溶液显 ___________ 色.
(2) 能说明第①步反应达平衡状态的是 ____________ 。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) =v (CrO42—)
c.溶液的颜色不变 d. 溶液的pH值不变
(3) 第②步中,还原0.01mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
(4) 许多过渡(金属)元素的氢氧化物在水中有两种电离方式,Cr(OH)3在溶液中存在以下平衡:H+ + CrO2—(亮绿色) + H2O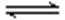
下列有关说法中正确的是
a、加酸则平衡向右移动,则生成Cr3+盐,加碱则平衡向左移动,生成亚铬酸盐(CrO2—)
b、在一定条件下存在:Cr(OH)3 + OH— → CrO2— + 2H2O ;Cr(OH)3 + 3H+ → Cr3+ + 3H2O
c、Cr3+盐中加入NaOH溶液,先产生沉淀,后沉淀消失,溶液变成无色
d、Cr(OH)3(固)在水中的存在叁个平衡
正确答案
(1)橙
(2)cd
(3)0.06
(4)ab
解析
略
知识点
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol/L的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g,下列说法不正确的是
正确答案
解析
略
知识点
铁是人类利用最为广泛的金属之一,工业炼铁一般用一氧化碳作还原剂。
(1)已知Fe2O3在高炉中有下列反应:Fe2O3+CO
a.7:3 b.21 8 c.14 5 d.7:2
(2)若m(Fe):m(O)=3:1,则Fe2O3与FeO的物质的量之比为_________,Fe2O3被CO还原的物质的量分数为___________ 。
(3)3.04 g Fe2O3和FeO的混合固体粉末在加热条件下用足量CO使金属氧化物完全还原,生成的CO2气体通入含0.04 mol Ca(OH)2的澄清石灰水后,产生3.00 g白色沉淀。计算固体粉末中Fe2O3的质量。(保留1位小数)
(4)常温下,称取不同铁锈样品溶入足量盐酸,向溶液中加入足量NaOH溶液生成沉淀,然后过滤、洗涤、灼烧,得到Fe2O3固体,实验过程中产品无损失。
实验数据记录如下:
上述实验①②③④所用铁锈均不含杂质,且实验数据可靠。通过计算,分析和比较上表4组数据,给出结论。
正确答案
(1)a、d
(2) 1:4 66.7%
(3)1.60 g
(4)①④是Fe2O3·3 H2O;②③是Fe2O3·2 H2O
解析
略
知识点
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为_______、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为_______。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_______。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板,则a端应连接电源的_______极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有_______。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是_______,发生反应的离子方程式为_______,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会_______(填“偏高”或“偏低”)。
正确答案
(1)Cu2S、FeS(每空1分);2FeS+3O2
(2)2/3mol
(3)正;Fe-2e-=Fe2+;Cu-2e-=Cu2+
(4)酸性高锰酸钾有强氧化性,能腐蚀碱式滴定管上的橡皮管(或易使橡皮管老化),所以不能用碱式滴定管盛酸性高锰酸钾溶液(必须答出两个要点:一是氧化性;二是橡皮管);5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;偏低。
解析
略。
知识点
扫码查看完整答案与解析