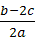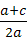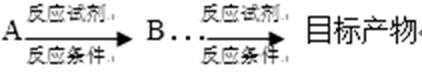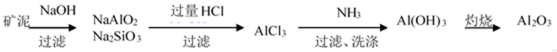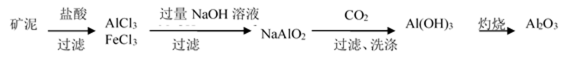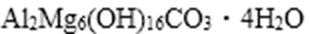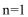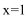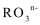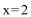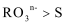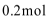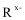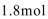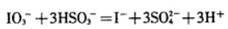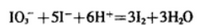- 氧化还原反应的计算
- 共67题
三氟化氮(NF3)在微电子工业中有重要用途,可由氨气和氟气反应得到,它在潮湿的空气中与水蒸气反应的产物有HF、NO和HNO3。下列说法错误的是
正确答案
解析
略。
知识点
卤素是重要资源,氯气和氯化氢都可以与氢氧化钠发生反应。
75. 标准状况下H2和Cl2组成的混合气体a mol,其中氯气的体积分数为w,经光照后缓缓通入含b mol NaOH的溶液中充分反应,测得最终溶液中含有c mol NaClO(c>0),则下列说法正确的是 。
a. 若c>b-a,则w=1— 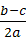
b. 若a+c>b,则w=1—
c. 若b=a+c,则w=0.5
d. 若a<b-c,则w=
浓硫酸吸收三氧化硫生成H2SO4·SO3在硫酸工业中是一个重要的反应,正确计算吸收所用的硫酸的量在充分利用原料等方面都可以节省一笔不小的财富。
76. 用1.00g 98%浓硫酸充分吸收三氧化硫后再稀释成98%浓硫酸,可以得到浓硫酸的质量是 。
77. 某地质学家经勘测发现一种新的磁黄铁矿,主要成分为Fe1-xS1+x,杂质不含Fe、S。分析可知该磁黄铁矿中,铁元素中三价铁的质量分数为75%。取5吨73%的该磁黄铁矿,用接触法制硫酸,若沸腾炉中煅烧的损耗率为4%,接触室中反应的转化率为94%,SO3的吸收效率为97%,则最多可制得98.3%的浓硫酸的质量是 (保留2位小数)。
铁铜元素与酸反应十分神奇,请完成如下计算:
78. 将部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,如图所示流程处理:
下列说法正确的是 。
a. 滤液A中阳离子为Fe2+、H+
b. 样品中金属Fe的质量为2.24g
c. 样品中CuO的质量为4.00g
d. V=448
铜和铜的氧化物与硝酸的氧化还原反应较为复杂,涉及很多计算。
79. 向Cu、Cu2O和CuO的混合粉末中加入500mL 0.6mol/L HNO3,恰好完全溶解,同时收集到1120mL NO(标准状况)。通过计算推断混合粉末中Cu的物质的量。
一鼓作气,再而衰,三而竭,彼竭我盈,方能克之。氯硫氮、钠铝铁,一个都别想逃!
80. 将m1g的氢氧化钠和碳酸氢钠的固体混合物,在300℃条件下充分加热,排出分解产生的气体,得到固体的质量为m2g,设m2/m1=a,则下列有关说法正确的是 。
a. a的取值范围是:53/84<a<53/62
b. a=53/65时,固体成分为碳酸钠、氢氧化钠
c. a=53/75时,固体成分为碳酸钠
d. 加热产生二氧化碳的物质的量总是小于水的物质的量
大自然中的矿物一般由多种氧化物组成,可以通过一些反应测定各成分含量。
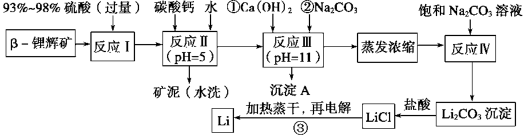
81. 制取金属锂的一种工艺流程如下:(β-锂辉矿主要成分LiAlSi2O6,含有FeO、MgO、CaO等杂质)
② 加入碳酸钙的目的是 。
② 请设计两种从水洗后的矿泥中分离出Al2O3的流程:
注:合成路线的表示方式为:
82. 铝和镁的碱式碳酸盐是一种中和胃酸过多的常用药物,某化学兴趣小组进行了以下实验:
① 取该碱式盐9.03g充分灼烧至恒重,测得剩余固体质量为5.13g;
② 另取该碱式盐3.01g使其溶于足量的盐酸中,产生CO2的体积为112mL(标准状况);
③ 向②的溶液中加入足量的NaOH溶液得到1.74g白色沉淀。
试通过计算确定该盐的化学式,并简述用盐的形式表示而不用氧化物形式表示的原因。
氯离子插层镁铝水滑石是一种新型的离子交换材料。制备这种水滑石的过程是:MgCl2、AlCl3、NaOH、NaCl溶液,按一定比例混合,在65℃充分反应后,经过滤、洗涤、干燥得到该水滑石。
83. 某实验小组为确定该水滑的成分,进行如下操作:
① 取26.65g样品,在高温下使其充分分解,得到金属氧化物和气体,气体依次通过足量的浓硫酸和浓氢氧化钠溶液,这两种液体分别增重9.9g和3.65g;将金属氧化物在无色火焰上灼烧,火焰仍无色。
② 另取26.65g样品,加入足量的稀硝酸,使其完全溶解,再加入NaOH溶液至过量,最终得到11.6g白色沉淀。
通过计算确定氯离子插层镁铝水滑石的化学式。
84. 氯离子插层镁铝水滑石在空气中放置,缓慢与CO2反应,部分氯离子会被碳酸根离子代替。26.65g样品在空气中放置一段时间后质量变为25.925g,则碳酸根离子代替部分氯离子的水滑石的化学式是 ,此过程的化学方程式是 。
铝合金由于其优良的性能,已经成为人类生活中常用的金属材料。硬铝-7075在航空工业中Zn-5.85%。有着广泛的应用,其化学成分为:Al-90.72%、Cu-1.39%、Mg-2.04%。已知:Zn+2NaOH→Na2ZnO2+H2↑。
85. 实验室将9g纯铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所

b. MnO2和V2O5
c. Cr2O3和V2O5
d. Fe3O4和FeO
86. 某学习小组为了验证硬铝-7075的成分,称取1.00g该硬铝,加入足量的氢氧化钠溶液中,充分反应后生成的气体经干燥后在标准状态下的体积为 L(保留3位有效数字)。实验时需配制2mol/L氢氧化钠溶液(ρ=1.08g/mL),其溶质质量分数为 (保留3位有效数字)。定量实验至少测定3组数据,配制时还需多备1组的量以防实验中操作错误,因此配制上述实验所用的氢氧化钠溶液,至少需要称量固体氢氧化钠 g。
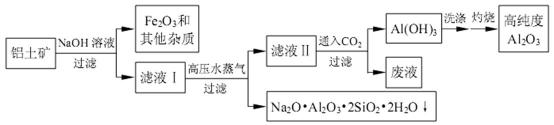
一种由铝土矿(主要含氧化铝,还有二氧化硅、氧化铁和其他杂质)的工艺流程如下:
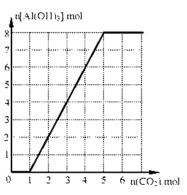
87. 取一定量的滤液Ⅱ,通入二氧化碳,生成氢氧化铝沉淀的量如图所示,当溶液中生成的碳酸钠为3mol时,通入的二氧化碳可能为 mol。
88. 实际生产中,由滤液Ⅱ到高纯度Al2O3(纯度99.0%)的过程中会损失2%的铝,熔融电解过程会损失电解熔融的氧化铝制取金属铝4%的铝,若要生产10吨硬铝-7075,至少需要多少吨含氧化铝55.6%、二氧化硅6.0%的铝土矿?(保留 3 位有效数字)
正确答案
见解析。
解析
75. bd
76. 2.22g
77. 6.08t
78. ad
79. 0.025mol<n(Cu)<0.075mol
80. cd
81. ① 除去反应Ⅰ中过量的H2SO4;控制pH使Fe3+、Al3+完全沉淀且Al(OH)3不溶解(2条都要写)
②
82.
用氧化物的形式无法表示出以离子形式存在的OH-
83. Mg2Al(OH)6·3H2O
85. ad
86. 1.15;0.0741(7.41%);8.00
87. 3或7
88. 36.4t
知识点
下列陈述I、II正确并且有因果关系的是:( )。
正确答案
解析
略
知识点
27. 海带是一种富含生物碘的海洋植物,碘是人体必需的微量元素,人体内碘的含量直接影响身体健康,为了防止缺碘,通常向食盐中加入碘酸钾(KIO3),以补充人体对碘的需求。已知:
以下为某兴趣小组从海带提取碘单质的过程:
(1) 实验室中焙烧海带时不能用到的仪器有________(填写相应的字母)。
(2)向浸取液中加入足量的双氧水和稀硫酸时所发生反应的离子方程式为:
。
(3)操作①中除用到玻璃棒外,还需要的玻璃仪器有 ;
(4)试剂A的名称为 (从上表给出的试剂中选择)。
(5)操作②的名称为 。
(6) 下图是进行蒸馏时的部分仪器,图中缺少玻璃仪器的名称是 。
(2)向浸取液中加入足量的双氧水和稀硫酸时所发生反应的离子方程式为:
。
(3)操作①中除用到玻璃棒外,还需要的玻璃仪器有 ;
(4)试剂A的名称为 (从上表给出的试剂中选择)。
(5)操作②的名称为 。
(6) 下图是进行蒸馏时的部分仪器,图中缺少玻璃仪器的名称是 。
(7)工业上可用碘制取碘酸钾,其反应为:I2+2KClO3=2KIO3+Cl2↑,下列有关叙述不正确的是 。
A.氧化性:I2>Cl2 B.每生成1 mol KIO3转移电子5 mol
C.该反应是置换反应 D.反应物和生成物中均含有共价键
(7)工业上可用碘制取碘酸钾,其反应为:I2+2KClO3=2KIO3+Cl2↑,下列有关叙述不正确的是 。
A.氧化性:I2>Cl2 B.每生成1 mol KIO3转移电子5 mol
C.该反应是置换反应 D.反应物和生成物中均含有共价键
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)

A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4vNi(CO)4=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+O2(g)==CO(g) H= -Q1 kJ·mol-1
C(s)+ O2(g)==CO2(g) H= -Q2 kJ·mol-1
S(s)+O2(g)==SO2(g) H= -Q3 KJ·mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g) H= kJ·mol-1 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(1)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(2)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.若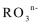
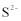
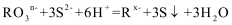
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.现有44g Mg、Al、Zn、Fe多种活泼金属粉末的混合物与体积为1L,质量分数为20%的硫酸溶液恰好完全反应,得到无水盐140g,则下列说法正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.做实验时不小心粘在皮肤上的高锰酸钾会形成黑斑,很久才能消除,若用乙二酸的稀溶液擦洗黑斑,黑斑可以迅速褪去,其离子反应方程式为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9. 在浓盐酸中

下列关于该反应的说法中,错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
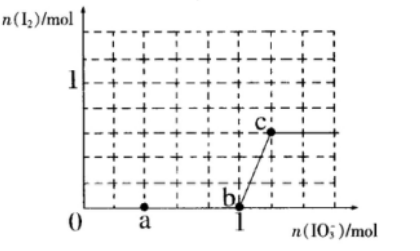
28.已知溶液中,还原性: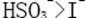
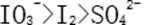
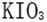
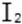
(1)a点处的氧化产物是( )(用离子符号填写,下同),还原产物是( ),a点对应的离子方程式为( )。
(2)当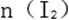
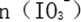
(3)当溶液中的I-为0.4mol时,加入的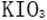
(4)若往100mL 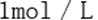
正确答案
(1)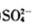
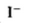
(2)1.2;
(3)1.12或0.4
(4)
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析