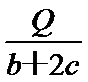- 有关过量问题的计算
- 共7题
16.80C,0.1 mol/L NaHB溶液中c(H+)>c(OH–),可能正确的关系是
正确答案
解析
A.为电荷守恒,但等式右边漏掉了 c(OH–),故A.错误;
B.当0.1 mol/L NaHB完全电离时,溶液的pH=1,因此可能正确的关系是选项B;
C.c(H+)∙c(OH–)= 10–14 是在常温下的水的离子积,故C.错误;
D.为物料守恒,但是等式右边缺少 c(B2–),故D.错误。
考查方向
解题思路
从信息c(H+)>c(OH–)推知NaHB溶液中电离程度大于水解程度。
易错点
忽视温度标准而错选C.c(H+)∙c(OH–)= 10–14。
知识点
8.能源是制约国家发展进程的因素之一。甲醇、二甲醚等被称为2 1世纪的绿色能源,工业上利用天然气为主要原料与二氧化碳、水蒸气在一定条件下制备合成气(CO、H2),再制成甲醇、二甲醚。
(1)工业上,可以分离合成气中的氢气,用于合成氨,常用醋酸二氨合亚铜 [Cu(NH3) 2] AC溶液(AC=CH3COO-)来吸收合成气中的一氧化碳,其反应原理为:
常压下,将吸收一氧化碳的溶液处理重新获得[Cu(NH3) 2] AC溶液的措施是_____________________;
(2)天然气的一个重要用途是制取H2,其原理为:CO

在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1____________P2(填 “大于”或“小于”);压强为P2时,在Y点:v(正) ____________v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K=____________。(计算结果保留两位有效数字)
(3)CO可以合成二甲醚,二甲醚可以作为燃料电池的原料,化学反应原理为:
①在恒容密闭容器里按体积比为1:4充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是____________; A.逆反应速率先增大后减小 C.反应物的体积百分含量减小 B.正反应速率先增大后减小 D.化学平衡常数K值增大
②写出二甲醚碱性燃料电池的负极电极反应式________________________;
③己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是____________(填字母) A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同 B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同 C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(4)已知l g二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63 kJ,请写出表示二甲醚燃烧热的热化学方程式________________________。
正确答案
(1)加热
(2)小于 大于 1.6( 可不写单位,若书写单位mol2/L2 单位错误不得分)
(3)①B、D
②CH3OCH3-12e-+16OH-=== 2CO32-+11H2O
③C
(4)CH3OCH3(g)+3O2(g) === 2CO2(g)+3H2O(l) ΔH=-1454.98 kJ/mol
解析
(1)[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)
故答案为:加热;
(2)该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
已知 CO2(g)+CH4(g)
其平衡常数表达式是
故答案为:小于;大于;1.6;
(3)①A.逆反应速率先增大后减小,可以升高温度,正逆反应速率都增大,平衡向着逆向移动,满足了逆反应速率先增大后逐渐减小,故A错误; B.正反应速率先增大后减小,说明是增大了压强或增加反应物浓度,无论改变哪一种条件,平衡一定向着正向移动,故B正确; C.反应物的体积百分含量减小,如减少反应物浓度,平衡会向着逆向移动,故C错误; D.化学平衡常数K值增大,说明生成物的浓度增大,反应物的浓度减小,平衡一定向着正向移动,故D正确;
故答案为:BD;
②二甲醚在碱性燃料电池的负极失去电子生成碳酸根离子和水,电极反应为CH3OCH3-12e-+16OH-═2CO32-+11H2O,
故答案为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
③化学反应实质是旧键的断裂和新键的生成,放出的能量与旧键断裂吸收的能量和新键的生成放出的能量有关,而二甲醚和乙醇分子中化学键类型不同,所以反应过程中放出的能量不同,所以C正确,
故答案为:C;
(4)1mol二甲醚的质量为46g,46g二甲醚完全燃烧生成稳定氧化物放出的热量为:31.63kJ×46g=1454.98 kJ,所以二甲醚燃烧热的热化学方程式为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol,
故答案为:CH3OCH3(g)+3O2(g)═2CO2(g)+3H2O(l)△H=-1454.98 kJ/mol.
考查方向
解题思路
(1)根据反应[Cu(NH3)2]AC(aq)+CO(g)+NH3(g)⇌[Cu(NH3)3]AC•CO(aq)△H<0为放热反应及温度对化学平衡的影响进行解答;
(2)该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;计算出达到平衡时各组分的物质的量及浓度,最后代人
计算出该温度下该反应的平衡常数;
(3)①根据影响化学平衡的因素进行判断满足“平衡一定向正反应方向移动”的选项;
②原电池负极发生氧化反应,二甲醚在碱性条件下失去电子生成碳酸根离子和水,据此写出电极反应;
③根据乙醇和二甲醚中结构简式不同,发生反应时断裂的化学键不同,反应放出的能量不会相同,据此进行判断;
(4)根据lg二甲醚气体完全燃烧生成稳定的氧化物放出的热量为31.63kJ计算出1mol二甲醚完全燃烧放出的热量,然后根据热化学方程式的书写方法写出二甲醚燃烧热的热化学方程式.
易错点
在(3)①中涉及到正逆反应速率大小影响到化学平衡平衡移动的方向是出错较多的知识点。
知识点
3.已知:①CH3OH(g)+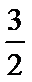
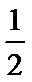
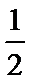
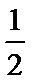
下列叙述不正确的是
正确答案
解析
A、气态水到液态水继续放热,所以d>c,故A正确;
B、燃烧热应生成稳定氧化物,应该是液态水,燃烧热为d kJ/mol,故B正确;
C、根据盖斯定律,CH3OH(g)═CO(g)+2H2(g),由①-②×2-③得到:CH3OH(g)═CO(g)+2H2(g)△H=(b+2c-a)kJ/mol,故C正确;
D、设CO和H2物质的量分别为n、2n,则CO放出的热量是nb,氢气放出的热量是2nd,即nb+2nd=Q,解得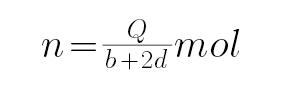
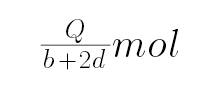
考查方向
化学反应与能量
解题思路
A、气态水到液态水继续放热,所以d>c;
B、燃烧热应生成稳定氧化物;
C、根据盖斯定律来计算焓变;
D、根据热化学方程式的系数和焓变的关系利用方程式进行计算
易错点
B项:燃烧热是生产稳定氧化物时放出的热量
教师点评
本题考查了化学反应与能量,涉及了一定量盖斯定律计算,难度不大
知识点
11.在给定条件下,下列加点的物质在对应的化学反应中能完全耗尽的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8、将烧碱溶液和盐酸依次滴入某溶液A中,其沉淀(Y轴)和加入溶液的体积(X轴)的关系可能出现两种图示形式,则A溶液不可能是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.在200 mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。下列叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.向
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析