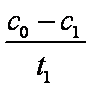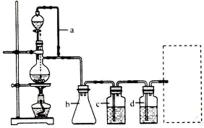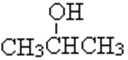- 化学反应速率的影响因素
- 共28题
某酸性工业废水中含有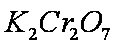
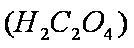
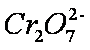
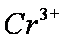
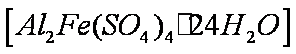
为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
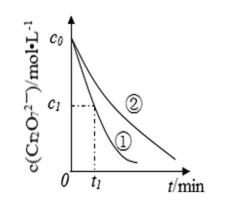
测得实验①和②溶液中的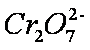
(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明 ;实验①中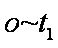
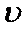
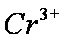
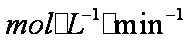
(4)该课题组队铁明矾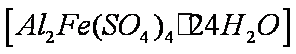
假设一: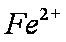
假设二: ;
假设三: ;
…………
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有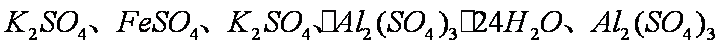
正确答案
(2)CO2
(3)PH越大,反应的速率越慢
(4)Al3+期催化作用;Fe2+和Al3+起催化作用
(5)取PH=5的废水60ml,加入10ml草酸和30ml蒸馏水,滴加几滴FeSO4,测定反应所需时间
预期现象与结论:与②对比,如果速率明显加快,故起催化作用的为Fe2+
解析
该反应为探究重铬酸根与草酸反应过程中的催化作用,该反应为一比较熟悉的反应,草酸被氧化后的产物为二氧化碳。
(3)考查了从图像中获取数据并分析的能力。图像越陡,反应速率越快
(4)对于假设可以从加入的物质铁明矾中获取,故为Fe2+和Al3+,然后根据上面的过程,进行对比实验,即可以得到答案。
知识点
捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
请回答下列问题:
(1)△H1与△H2、△H3之间的关系是:△H3= 。
(2)为研究温度对(NH4)2CO3捕获CO2气体效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,得到趋势图(见图1)。则:
①△H3 0(填“>”、“=”或“<”)。
②在T1-T2及T4- T5二个温度区间,容器内CO2气体浓度呈现如图1所示的变化趋势,其原因是 。
③反应Ⅲ在温度为T1时,溶液pH随时间变化的趋势曲线如图2所示。当时间到达t1时,将该反应体系温度迅速上升到T2,并维持该温度。请在该图中画出t1时刻后溶液的pH变化趋势曲线。
(3)利用反应Ⅲ捕获CO2,在(NH4)2CO3初始浓度和体积确定的情况下,提高CO2吸收量的措施有 (写出2个)。
(4)下列物质中也可能作为CO2捕获剂的是
aNH4Cl
bNa2CO3
cHOCH2CH2OH
dHOCH2CH2NH2
正确答案
见解析。
解析
(1)2△H2—△H1
(2)①<
②T1-T2区间,化学反应未达到平衡,温度越高,反应速率越快,所以CO2被捕获的量随温度的升而提高。T4- T5区间,化学反应已到达平衡,由于正反应是放热反应,温度升高,平衡向逆反应方向移动,所以不利于CO2的捕获。
③
(3)降低温度;增加CO2浓度(或压强)
(4)BD
知识点
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
CH3CH=CH2+CO+H2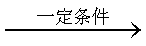
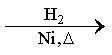
CO的制备原理:HCOOH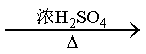
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸、2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:_________,_________。
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是_________,_________。c和d中盛装的试剂分别是_________,_________。若用以上装置制备H2,气体发生装置中必需的玻璃仪器名称是_________;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是_________(填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)合成正丁醛的反应为正向放热的可逆反应,为增大反应速率和提高原料气的转化率,你认为应该采用的适宜反应条件是_________。
a.低温、高压、催化剂 b.适当的温度、高压、催化剂
c.常温、常压、催化剂 d.适当的温度、常压、催化剂
(5)正丁醛经催化加氢得到含少量正丁醛的1-丁醇粗品。为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)
粗品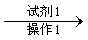


试剂1为_________,操作1为_________,操作2为_________,操作3为_________。
正确答案
(1)Zn+2HCl
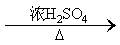
(2)恒压;防倒吸;NaOH溶液;浓H2SO4;分液漏斗、蒸馏烧瓶;
(3)④⑤①②③(或④⑤①③②)
(4)b
(5)饱和NaHSO3溶液;过滤;萃取;蒸馏
解析
(1)实验室用锌粒和稀盐酸制备氢气;用2-丙醇和浓硫酸共热,消去反应制备丙烯;
(2)在题给装置中,a的作用保持分液漏斗和烧瓶内的气压相等,以保证分液漏斗内的液体能顺利加入烧瓶中;b主要是起安全瓶的作用,以防止倒吸;c为除去CO中的酸性气体,选用NaOH溶液,d为除去CO中的H2O,试剂选用浓硫酸;若用题给装置制备H2,则不需要酒精灯,必须得是反应容器和滴加盐酸的仪器,氢气用向下排空气法收集,注意导气管伸入底部;
(3)检验丙烯和少量SO2、CO2及水蒸气组成的混合气体各成分时,应首先选④无水CuSO4检验水蒸气,然后用⑤品红溶液检验SO2,并用①饱和Na2SO3溶液除去SO2;然后用③石灰水检验CO2,用②酸性KMnO4溶液检验丙烯,特别注意不能用酸性高锰酸钾溶液除去二氧化硫;
(4)题给合成正丁醛的反应为气体体积减小的放热反应,为增大反应速率和提高原料气的转化率,选b;(5)由操作1后得到“滤液”和信息①可知,试剂1应为NaHSO3饱和溶液,操作为过滤;加入乙醚时1-丁醇易溶解于其中,故操作2为萃取分液;根据两种有机物沸点的不同,操作3应为蒸馏。
知识点
氯酸钾和亚硫酸氢钠起氧化还原反应生成Cl

正确答案
解析
略
知识点
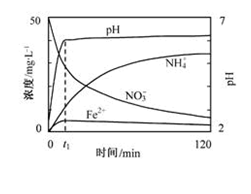
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响。
(1)实验前:①先用0.1mol·L-1H2SO4洗涤Fe粉,其目的是_________,然后用蒸馏水洗涤至中性;②将KNO3溶液的pH调至2.5;③为防止空气中的O2对脱氮的影响,应向KNO3溶液中通入_________(写化学式)。
(2)上图表示足量Fe粉还原上述KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式_________。t1时刻后,该反应仍在进行,溶液中NH4+的浓度在增大,Fe2+的浓度却没有增大,可能的原因是_________。
(3)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
假设一:溶液的pH;
假设二:_____________;
假设三:_____________;
……
(4)请你设计实验验证上述假设一,写出实验步骤及结论。(已知:溶液中的NO3 -浓度可用离子色谱仪测定)
正确答案
(1)除去铁表面的氧化膜;NO
(2)4Fe+10H++NO3-=Fe2++NH4++3H2O;硝酸根离子在酸性环境下氧化氮氧化物
(3)溶液的温度;使用催化剂
(4)将两份相同的KNO3溶液的pH分别调至2.5和3.5,分别加入等量且足量Fe粉,等反应完成后,用离子色谱仪分别测定溶液中NO3-浓度,如果前者NO3-浓度低,说明酸性越强脱氮速率越快。
解析
略。
知识点
扫码查看完整答案与解析