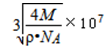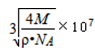- 硅和二氧化硅
- 共34题
12.氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。回答下列问题:
(1)基态砷原子的电子排布式为 .
(2)K3[Fe(CN)6]晶体中Fe3+与CN之间化学键类型为

(3)PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有NOx、O3、CH2=CHCHO、HCOOH、CH3—C—0—0—N02 (PAN)等二次污染物。
①N20结构式可表示为N = N = 0,N20中中心氮原子的杂化轨道类型为 ,1 mol PAN中含σ键数目为 。
②测定大气中PM2.5的浓度方法之一是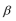
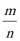
正确答案
(1)1s22s22p63s23p63d104s24p3;
(2)配位键;CO;
(3)sp 10NA
(4)3
解析
(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;
(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键。原子数相同、电子数也相同的物质称为等电子体,运用等量异质替换将,N原子电子数加1得O原子,可得CN-的等电子体为CO;故答案为:配位键、CO
(3)N20结构式可表示为N=N=0,N20中中心氮原子的价层电子对的数目为(5-1)/2=2。所以杂化方式为sp。一个单键就是一个σ键,一个双键含有一个σ键和一个π键;根据PAN的结构式: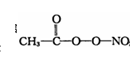
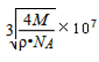
考查方向
解题思路
(1)As的原子序数为33,基态原子的电子排布式为1s22s22p63s23p63d104s24p3(2)K3[Fe(CN)6]晶体中Fe3+与CN-之间的化学键类型为配位键,Fe3+有空轨道,能接受孤对电子,CN-能提供孤对电子,所以能形成配位键;原子数相同、电子数也相同的物质称为等电子体,运用等量异质替换将,N原子电子数加1得O原子,可得CN-的等电子体;
(3)N20结构式可表示为N = N = 0,根据N20中中心氮原子的价层电子对的数目判断杂化方式,一个单键就是一个σ键,一个双键含有一个σ键和一个π键;
(4)以顶点为为计算,与相邻的最近的Kr位于三个面上,而顶点的原子为8个立方体共有,每个面心的原子为2个立方体共有,故与每个Kr原子相紧邻的Kr原子有3×4=12,晶胞中含有的Kr原子为8×(1/8)+6×(1/2)=4,然后求出比值,根据=m/V求得晶胞的体积,进而求出边长;
易错点
对物质结构知识把握不准确;由于不能有效掌握等电子体的实质与分析策略,所
以不能快速准确写出等电子体;空间想象能力薄弱,不能通过密度和参数a的关系进行准确
计算;不注意单位换算致错。
知识点
1.Si、SiO2广泛用于制造晶体管、光导纤维等。下列有关说法正确的是()
正确答案
解析
A、硅和二氧化硅与碱液都反应,所以碱液浸泡除去油污的同时又腐蚀了晶体,故A错误;B、二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以形成光的断路,所以光导纤维遇碱会影响光信号传输,故B正确;C工业上用SiO2热还原法冶炼硅,而不是热分解法冶炼硅,故C错;D、但在自然界中仍以化合态形式存在,如二氧化硅、硅酸盐等,不是以游离态形式存在,故D错误;
考查方向
解题思路
A、硅和二氧化硅与碱液都反应;B、二氧化硅能用于制光导纤维、二氧化硅能与氢氧化钠溶液反应,生成硅酸钠和水,所以形成光的断路;C、工业上用SiO2热还原法冶炼硅;D、但在自然界中仍以化合态形式存在,如二氧化硅、硅酸盐等.
易错点
碳族元素.
知识点
4.下列有关物质的性质和用途的说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
2.下列化学用语表示正确的是( )
正确答案
解析
A.中子数为20,其质量数为20+17=37,中子数为20的氯原子为
B.二氧化硅是原子晶体,不存在单个分子结构(分子存在于分子晶体),SiO2仅仅体现了原子的个数比,是一个宏观的表示方法,并不是分子式,B错误;
C.H2S是共价化合物,硫原子分别与两个氢原子通过一对共用电子对结合,H2S的结构式是H-S-H,C正确;
D.氯化铵的电子式应该为:
故选C。
考查方向
解题思路
A.中子数为20,其质量数为20+17=37,中子数为20的氯原子为
B.二氧化硅是原子晶体,不存在单个分子结构(分子存在于分子晶体),SiO2仅仅体现了原子的个数比;
C.H2S是共价化合物,硫原子分别与两个氢原子通过一对共用电子对结合,H2S的结构式是H-S-H;
D.氯化铵的电子式应该为:
易错点
本题考查了常见化学用语的书写判断,题目难度中等,注意掌握原子分子式、电子式、结构式、元素符号的概念及表示方法。
知识点
8.粉煤灰中含有SiO2、Al2O3、Fe2O3等,某实验室对其进行处理的流程如图所示:
回答下列问题:
(1)第①步得到的“熟料”中可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,等物质的量浓度的NH4Fe(SO4)2、NH4 Cl、CH3COO NH4 的溶液中NH4+ 的浓度由小到大的顺序为
(2)滤渣B的主要成分为 ,其与NaOH溶液反应的离子方程式为 .
(3)已知KSP[Fe(OH)3]=4×10﹣
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、 、 ,得到的晶体主要成份是(填化学式) .第⑤步所加试剂D是 
正确答案
(1)CH3COO NH4<NH4 Cl<NH4Fe(SO4)2
(2)SiO2、SiO2+2OH﹣=SiO32﹣+H2O;
(3)6 ;H++HCO3﹣=H2O+CO2↑;
(4)玻璃棒;蒸发皿;(NH4)2SO4;NaOH溶液;[Al(OH)4]-+CO2+H2O= Al(OH)3↓+HCO3-
解析
(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2、氨气和水,发生反应的化学方程式为Fe2O3+4NH4HSO4
(2)SiO2不溶于一般酸性溶液,不溶于氨水;SiO2与NaOH溶液反应的离子方程式为SiO2+2OH﹣=SiO32﹣+H2O;
故答案为:SiO2、SiO2+2OH﹣=SiO32﹣+H2O;
(3)根据KSP=1×10﹣33;c(Al3+)均小于或等于1×10﹣9molL﹣1可认为完全沉淀,此时c(OH﹣)==1×10﹣8;在酸性溶液中,H++HCO3﹣=H2O+CO2↑;
故答案为:6;H++HCO3﹣=H2O+CO2↑;
(4)实验室进行第④步操作时,滤液C得到硫酸铵,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;第⑤步所加试剂NaOH,生成四羟基合硫酸根离子,第⑥步生成Al(OH)3的离子方程式为通入CO2,酸碱中和生成(NH4)2SO4;
故答案为:玻璃棒;蒸发皿;(NH4)2SO4;NaOH溶液;[Al(OH)4]-+CO2+H2O= Al(OH)3↓+HCO3-
考查方向
本题主要考查了考查物质制备实验分析判断,物质性质的理解应用,离子方程式、化学方程式书写方法,盐类水解分析应用。
解题思路
(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2、氨气和水,发生反应的化学方程式为Fe2O3+4NH4HSO4
(2)SiO2不溶于一般酸性溶液,不溶于氨水,所以滤渣B的主要成分为SiO2 。
(3)由于Ksp[Fe(OH)3]=4×10-38< Ksp [Al(OH)3]=1×10-32,Fe(OH)3先出现沉淀,根据Ksp [Al(OH)3]=1×10-32;c(Al3+)均小于或等于1×10﹣5 mol•L﹣1可认为完全沉淀,此时c(OH﹣)==1×10﹣9,c(H+)= 1×10﹣5,PH=5,所以溶液A至少应调节到pH=5。
(4)实验室进行第④步操作时,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;滤液C的主要成分是硫酸铵溶液,所以得到的晶体是硫酸铵。
易错点
1.离子方程式、化学方程式书写。
2. 根据Ksp判断沉淀。
知识点
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
24.CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1则CO还原Fe2O3(s)的热化学方程式为_________ 。
25.分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:_________ 。
26.CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g)
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
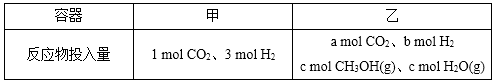
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入
反应物,一段时间后达到平衡。
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
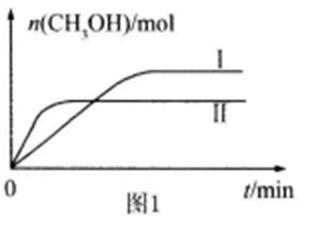
27.利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化见图2。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为 (填序号)。
28.以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率的关系见图3。
①乙酸的生成速率主要取决于温度影响的范围是_________________________。
②Cu2Al2O4可溶于稀硝酸,写出有关的离子方程式:________________________________ 。
正确答案
Fe2O3(s)+ 3CO(g)=2Fe(s)+ 3CO2(g) △H =-28.5 kJ·mol-1
解析
a、Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ?mol-1
b、C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
依据盖斯定律a-b×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ?mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ?mol-1;
考查方向
解题思路
根据题干求出结果
易错点
化学平衡K值大小的比较
正确答案
O + 4OH-― 2e-= CO32-+ 2H2O
解析
CO-O2燃料电池(以KOH溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳在溶液中生成碳酸钾,原电池负极电极反应为:CO+4OH--2e-=CO32-+2H2O,故答案为:CO+4OH--2e-=CO32-+2H2O;
考查方向
解题思路
根据题干求出结果
易错点
化学平衡K值大小的比较
正确答案
①> ②0.4<c≤1
解析
①根据图象可知,线Ⅱ的反应速率大于线Ⅰ,所以线Ⅱ对应的温度高于线Ⅰ,而线Ⅱ对应的甲醇的物质的量小,也就是说温度高反应平衡逆向移动,据此判断反应的△H<0,根据温度对平衡移动的影响可知,升高温度,平衡向吸热方向移动,而该反应为放热反应,所以升高温度平衡逆向移动,平衡常数变小,即KⅠ>KⅡ,
故答案为:小于;>;
②利用三段式,根据等效平衡的思想可知
设平衡时二氧化碳转化了xmol,
CO2(g)+3H2(g)
开始1(mol): 1 3 0 0
变化1(mol): x 3x x x
平衡1(mol):1-x 3-3x x x
开始2 a b c c
则由题意可知:(x+x+1-x+3-3x)/(1+3)=0.8,解得x=0.4,
根据恒温恒容条件下的等效平衡的思想则有开始1和开始2为完全等效,即a+c=1,要使反应始终向逆向进行,则c>x,故a的范围为小于等于1大于0.4,
故答案为:0.4<c≤1;
考查方向
解题思路
根据题干求出结果
易错点
化学平衡K值大小的比较
正确答案
II>III>I
解析
由图2可知,在0~15小时内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅲ)<△n(Ⅱ),故在0~30h内,CH4的平均生成速率v(Ⅱ)>v(Ⅲ)>v(Ⅰ),故答案为:I<III<II;
考查方向
解题思路
根据题干求出结果
易错点
化学平衡K值大小的比较
正确答案
①300℃~400℃
②3Cu2Al2O4+32H++2NO3-= 6Cu2++ 6Al3++2NO↑+16 H2O
解析
①根据图象3可知,当温度大于300℃时,线的斜率变化较大,也就是温度对化学反应速率的影响较大,故答案为:300℃~400℃;
②Cu2Al2O4拆成氧化物的形式:Cu2O?Al2O3,与酸反应生成离子方程式:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O,
故答案为:3Cu2Al2O4+32H++2NO3-=6Cu2++6Al3++2NO↑+16H2O.
考查方向
解题思路
根据题干求出结果
易错点
化学平衡K值大小的比较
7.下列推断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.下表中各组物质之间不能通过一步反应实现如图转化的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7.下列推断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
8.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析