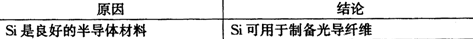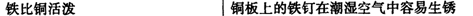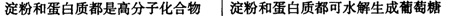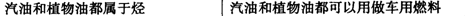- 硅的用途
- 共21题
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态硅原子中,电子占据的最高能层符号为 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸盐、 等化合物形式存在于地壳中。
(3)单质硅存在与金刚石类似结构的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷分解来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应得到SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是 。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构形式。图(b)为一种无限长单链结构的硅酸根:其中硅原子的杂化形式为 ,Si与O原子数之比为 ,化学式为 。
正确答案
(1)M;9;4
(2)二氧化硅
(3)共价键;3
(4)Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2
(5)①C-C和C-H较强,所形成的烷烃稳定,而硅烷中的Si-Si和Si-H的键能低,易断裂,导致长链硅烷难以形成。
②C-H键能大于C-O,C-H比C-O稳定。而Si-H键能小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键
(6)sp3;1∶3;[SiO3]n2n-或SiO32-
解析
略
知识点
化学在生产和日常生活中有着重要的应用,下列说法不正确的是
正确答案
解析
略
知识点
化学与生活密切棚关。下列选项中原因与结论均正确的是
正确答案
解析
略
知识点
化学与生产、生活密切相关。下列说法正确的是
正确答案
解析
略
知识点
1.据报导,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普通使用的新型能源被开发利用,关于其有利因素的下列说法中不正确的是()
正确答案
解析
略
知识点
下列说法正确的是
正确答案
解析
略。
知识点
化学与科学、技术、社会、环境密切相关。下列说法不正确的是
正确答案
解析
略
知识点
化学与社会、生活密切相关。下列说法正确的是
正确答案
解析
略
知识点
7.下列说法正确的是( )
正确答案
解析
略
知识点
6.下列说法正确的是 ( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析