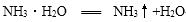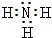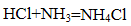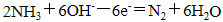- 电极反应和电池反应方程式
- 共352题
用A.b两个惰性电极电解0.2L一定浓度的硫酸铜溶液,当a极上产生4.48L(标况)气体时,b极上只有固体析出。然后将电源反接,当b极产生4.48L(标况)气体时,溶液质量共减少45.4克。下列说法正确的是( )
正确答案
解析
略
知识点
下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是
正确答案
解析
略
知识点
氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=―92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=―159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O (l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 。
(2)CO在催化剂作用下可以与H2反应生成甲醇CO(g)+2H2(g) 
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M):n(N)= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑ 2HN3+Zn=Zn(N3)2+H2↑
则2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 。
(4)已知H2S高温热分解制H2的反应为: H2S(g)

(5)用惰性电极电解煤浆液制H2的反应为: C(s)+2H2O(l)=CO2(g)+2H2(g) 现将一定量的1 mol·L-1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL-1~0.12g·mL-1的煤浆液,置于上图2所示装置中进行电解(两电极均为惰性电极),则A极的电极反应式为 。
正确答案
(1)
(2)① 5:4 ②KM=KN>KQ
(3)2 mol
(4) 0.4c/t mol·L-1·min-1;温度升高,反应速率加快,达到平衡所需的时间缩短(合理答案均可)
(5)C+2H2O-4e-=CO2↑+4H+
解析
略
知识点
最近有研究人员发现了一种处理高浓度乙醛废水的新方法—隔膜电解法,乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸。实验室以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。下列说法正确的是
正确答案
解析
略
知识点
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是 ,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚(
①B是电池的 极(填“正”或“负”);②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。
① 阳极的电极反应式为 。
② 简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g•L-1乳酸溶液通电一段时间后,浓度上升为145 g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g• mol-1)
正确答案
见解析。
解析
(1)①C、N同周期,原子半径:N<C;非金属性:N>C;得电子能力N>C
②2CN-+O2+4H2O 
(2)①负②
(3)①4OH-—4e-=2H2O+O2↑
② 阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;A-通过阴离子交换膜从阴极进入浓缩室,H+ +A- = HA,乳酸浓度增大。
③ 6.72
知识点
能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下可实现如下变废为宝的过程:
上述过程的总反应是_________,该反应将太阳能转化为_________。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为_________。该电池反应可获得





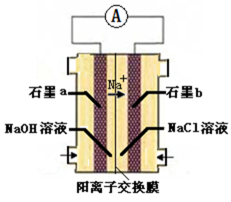
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
①电解过程中发生反应的离子方程式是_________,阴极附近溶液pH_________(填“不变”、“升高”或“下降”)。
②如果粗盐中

a.Ba(OH)2
b.Ba(NO3)2
c.BaCl2
现代工艺中更多使用
③图中氢氧化钠溶液的质量分数a%_________b%(填“>”、“=”或“<”),燃料电池中负极上发生的电极反应为_________。
正确答案
(1)H2O + CO2 =H2 + CO + O2;化学能
(2)CO – 2e- +4OH- = CO32- + 2H2O;×10-4 mol·L-1
(3)①2Cl-+2H2O 
解析
略。
知识点
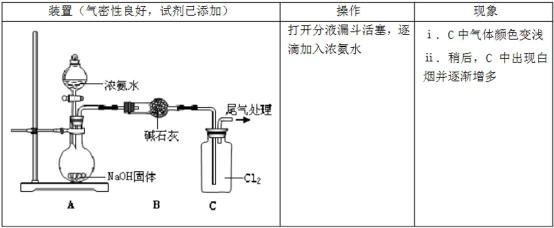
某同学模拟工业“折点加氯法”处理氨氮废水的原理,进行如下研究。
(1)A中反应的化学方程式是 。
(2)现象ⅰ,C中发生的反应为:2NH3(g)+3Cl2(g)= N2(g)+6HCl(g) H= —456 kJ·mol-1
已知:
①NH3的电子式是 。
②断开1mol H-N键与断开1molH-Cl键所需能量相差约为 ,NH3中的H-N键比HCl中的H-Cl键(填“强”或“弱”) 。
(3)现象ⅱ中产生白烟的化学方程式是 。
(4)为避免生成白烟,该学生设计了下图装置以完成Cl2和NH3的反应。
若该装置能实现设计目标,则
② 石墨b电极上发生的是 反应(填“氧化”或“还原”)
②写出石墨a电极的电极反应式: 。
正确答案
见解析。
解析
(1)
(2)①
②40 弱
(3)
(4)①还原
②
知识点
用如图所示装置处理含NO3-的酸性工业废水,某电极反应式为2NO3-+12H++10e-=N2+6H2O,则下列说法错误的是
正确答案
解析
略。
知识点
储氢合金表面镀铜过程发生反应
正确答案
解析
略。
知识点
某兴趣小组设计如下微型实验装置,实验时,先断开K2,闭合K1,两极均有 气泡产生,一段时间后,断开K1,闭合K2,发现电流计A指针偏转,下列有关描述正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析