- 电极反应和电池反应方程式
- 共352题
下列各组中,每种电解质溶液电解时只生成氢气和氧气的是( )
正确答案
解析
电解HCl的方程式为:


知识点
糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
正确答案
解析
略
知识点
右图装置中发生反应的离子方程式为:Zn+2H+→Zn2++H2↑,下列说法错误的是
正确答案
解析
本题通过电化学知识意在考查考生的电化学知识和考生对问题的分析、处理能力。图示装置既可以是电解池,阳极的电极材料为Zn、阴极的电极材料为Zn或其他可导电的材料,如Cu、石墨等,电解质溶液为盐酸或硫酸等,故A项错、B项正确;该装置也可是原电池,此时电池负极材料为Zn、正极材料为比Zn活泼性差的可导电的材料,如Cu、石墨等,电解质溶液为盐酸或硫酸等,故C、D项正确。
知识点
下列解释事实的方程式不准确的是
正确答案
解析
A、盐酸具有挥发性,挥发出的HCl与氨气反应生成氯化铵,冒白烟,故正确;
B、碳酸钠是强碱弱酸盐,溶液中存在CO2-3水解平衡:CO2-3+H2O
C、钢铁发生吸氧腐蚀,铁作负极被氧化,电极反应式为Fe-2e-=Fe2+,故错误;
D、石灰水与空气中的二氧化碳反应生成碳酸钙,故正确。
知识点
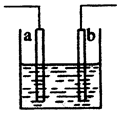
用石墨电极电解CuCl2溶液(见下图)。下列分析正确的是
正确答案
解析
A、由溶液中离子移动方向可知,U型管左侧电极是阴极,连接电 源的负极,a端是电源的负极,故正确;
B、通电使CuCl2发生电解,不是电离,故错误;
C、阳极发生氧化反应,Cl-在阳极放电2Cl--2e-=C12↑,故错误;
D、Cl-发生氧化反应,在阳极放电生成Cl2,故D错误。
知识点
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是
正确答案
解析
该电解池为电解水,阴极4H2O+4e-

知识点
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示S形成硫酸酸雨的反应。
(2)在钠碱循环法中,Na₂SO₃溶液作为吸收液,可由NaOH溶液吸收SO₂制得,该反应的离子方程式是
(3)吸收液吸收SO₂的过程中,pH随n(SO₃²﹣),n(HSO₃﹣)变化关系如下表:
①上表判断Na ₂SO₃溶液显 性,用化学平衡原理解释:
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):
(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如下:
①HSO3在阳极放电的电极反应式是 。
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用。简述再生原理:
。
正确答案
见解析。
解析
(1)SO2+H2O

二氧化硫形成硫酸型酸雨过程是二氧化硫与水反应生成亚硫酸,亚硫酸被氧化成硫酸;或二氧化硫在空气中遇漂尘(作催化剂)被氧化成SO3,直接与水反应生成硫酸。
(2)2OH-+ SO2=H2O+SO32-
氢氧化钠吸收二氧化硫生成亚硫酸钠和水,而亚硫酸钠溶液可以继续吸收二氧化硫生成亚硫酸氢钠。
(3)①酸
HSO3-存在:HSO3-

②a b
(4)①HSO3-+H2O-2e-= SO42-+3H+
②H+在阴极得电子生成H2,溶液中c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液就可以再生。
知识点
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH3COOH+4H+。下列有关说法正确的是
正确答案
解析
本题考查的是原电池和电解池原理。原电池中H+移向电池的正极,A项错误;该原电池的总反应为乙醇的燃烧方程式,C项正确,用C项的方程式进行判断,有0.4 mol的电子转移,消耗氧气为0.11 mol,B项错误;酸性电池不可能得到OH—,D项错误。
知识点
根据右图,可判断出下列离子方程式中错误的是
正确答案
解析
如图原电池中,Cd为负极,其电极总反就式为Co2+(aq)+Cd(s)==Co(s)+Cd2+(aq),B项研确;右图原电池中,Co为负极,其电极总反就式为2Ag+(aq)+Co(s)==2Ag(s)+Co2+(aq),D项正确。再由B、D两式可得,氧化性为Ag+ >Co2+>Cd2+,因此可得
2Ag+(aq)+Cd(s)==2Ag(s)+Cd2+(aq),故C项也正确;氧化性为Ag+>Cd2+,所以A项方程式的反应不能发生,A错。
知识点
(1)电镀是,镀件与电源的 极连接。
(2)化学镀的原理是利用化学反应生成金属单质沉淀在镀件表面形成的镀层。
①若用铜盐进行化学镀铜,应选用 (填“氧化剂”或“还原剂”)与之反应。
②某化学镀铜的反应速率随镀液pH变化如右图所示。该镀铜过程中,镀液pH控制在12.5左右。据图中信息,给出使反应停止的方法:
(3)酸浸法制取硫酸铜的流程示意图如下:
①步骤(i)中
②步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
③在步骤(iii)发生的反应中,1mol
④步骤(iv)除去杂质的化学方程式可表示为
过滤都母液的pH=2.0,c(





正确答案
见解析。
解析
(1)负;考察电镀池的常规考题。送分题。
(2)①还原剂;要使铜离子得电子转化为铜单质,只能用还原剂。本题考察氧化还原反应的最普通知识,又是送分题。
②调节溶液PH在8-9之间。从图表信息可知,当PH在8-9之间时候,反应速率为0,有些同学可能会问在PH为什么一定要大于8,别忘了化学镀铜用的还原剂一般是比铜活泼的还原剂(比如活泼金属),那么在酸性条件下,可能会产生H2,因此最好在碱性条件下调节PH。
(3)①Cu2(OH)2CO3+2H2SO4=== 2CuSO4+3H2O+ CO2↑ 能对复分解反应熟悉的同学,一般能推出生成物,难度中等。
②HCO3- 。考察同学们对水解知识的理解,题目中特别指出将PH调高,HCO3-水解呈碱性。
③MnO2+2Fe2++4H+=== 2Fe3++Mn2++ 2H2O,难度中上,MnO2具有比较强的氧化性,而1mol的MnO2转移2mol的电子,其隐含信息就是还原产物为Mn2+,通过最终产物NH4Fe2(SO4) 2 (OH) 6可判断此时的Fe都是+3价,那原先的部分+2价Fe肯定是被MnO2氧化所致。
④
知识点
扫码查看完整答案与解析