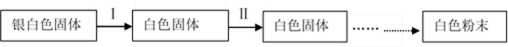- 电极反应和电池反应方程式
- 共352题
金属及其化合物在生活、科研、生产中有着重要的作用。
(1)皮肤粘上高锰酸钾形成的黑斑很久才能消除,如果用H2C2O4(乙二酸为二元弱酸)的稀溶液洗涤,黑斑可以迅速褪去,写出该反应的离子方程式________。
(2)下图为某蓄电系统的示意图。反应原理为:2Na2S2+NaBr3
当蓄电池放电时,Na+的移动方向是从________到________(填a、b),电极b的电极反应式为________。用该电池做电源,用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的状态(不考虑CO2溶解),电解池的阳极反应为________,整个过程中转移的电子数目________。
(3)向含有Ca2+、Mn2+的溶液中加入NH4HCO3,能够生成MnCO3沉淀,写出生成沉淀的离子方程式________。剩余溶液中
正确答案
(1)2MnO4-+5H2C2O4+6H+=2Mn2++5CO2↑+8H2O
(2)ab;Br3-+2e-=3Br-;4OH--4e-=2H2O+O2 ↑;0.6Na或3.612×1023
(3)Mn2++2HCO3-=MnCO3↓+CO2+H2O;500
解析
略。
知识点
25.(1)一定温度下,向某容积固定的密闭容器中加入适量(NH4)2S固体,发生如下反应:
① (NH4)2S(s) 
② H2S(g) 
达到平衡时测得H2S和H2物质的量浓度分别为4 mol·L-1和1mol·L-1。则反应①的化学平衡常数K= 。
(2)25℃时,向20 mL 0.1mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,当NaOH溶液分别加到:①10 mL、②20 mL、③c (Na+)=c (CH3COO-)、④40 mL时,下列说法正确的是 。(填序号)
A.①中溶液显酸性,则c(Na+)>c(CH3COOH)
B.②中存在c (CH3COOH)+ c (CH3COO-)=0.05mol·L-1
C.③中混合溶液体积大于40 mL
D.④中水电离出的c(H+)最大
(3)密闭容器中发生下列反应:A(g)+B(g) 
(4)已知1.6 g液态甲醇在室温时完全燃烧放出的热量为68.4 kJ,则该条件下甲醇燃烧的热化学方程式为 。
若将甲醇的燃烧反应设计成原电池装置,能量的利用率会更高,当电解质溶液为酸性时,该电池负极的电极反应式为 。
(5)室温时,Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6。含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)=0.2 mol · L-1,如果加入等体积的CaCl2溶液,若要产生CaCO3沉淀,加入CaCl2溶液的物质的量浓度最小约为 。
正确答案
(1)400
(2)AB
(3)
(4)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H= -2736kJ·mol-1
CH3OH-6e-+H2O=CO2+6H+
(5)1.45×10-4mol · L-1
解析
略
知识点
工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。下列说法中正确的是
正确答案
解析
略。
知识点
已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系中SO3的百分含量和温度的关系如右图所示(曲线上点均为平衡状态)。由图可知:
①2SO2(g) + O2(g)
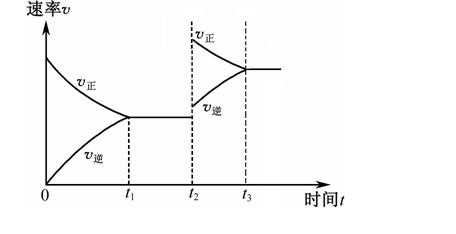
②若温度为T1时,反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO 
(3)有人设想用下图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为 ;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为 L/min(标准状况)。
正确答案
见解析。
解析
(1) ① < ; 向左; ② > ;
③ SO2+H2O+2NH3 = (NH4)2SO3 、
(NH4)2SO3+H2SO4 = (NH4)2SO4+SO2↑+H2O ;
④ (NH4)3PO4(或(NH4)2HPO4 、NH4H2PO4);
(2)使CO与NO反应,生成可参与大气生态环境循环的无毒气体;
(3)① CO2+6H++6e-= CH3OH+H2O ; ② 2240 。
知识点
下图为两个原电池装置图,由此判断下列说法错误的是
正确答案
解析
略。
知识点
甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的两根石墨棒C1、C2插入乙,把分别与直流电源正、负极相连的石墨棒C3、铁片插入丙。则下列叙述正确的是
正确答案
解析
略
知识点
滴有酚酞和氯化钠试液的湿润滤纸分别做甲乙两个实验,能发现附近变成红色的电极是

甲 乙
正确答案
解析
略
知识点
切开的金属Na暴露在空气中,其变化过程如下:
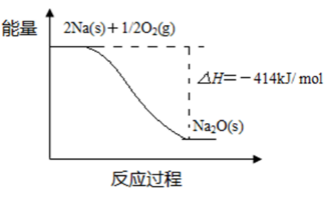
(1)反应Ⅰ的反应过程与能量变化的关系如下:
① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是 。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
a.升高温度,溶液的pH降低
b.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
c.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
d.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(4) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因_______。
② ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na 
正确答案
见解析。
解析
(1)①放热 反应物总能量高于生成物总能量
② Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol
(2)
(3)b c
(4)① 最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强。
② NiCl2+ 2Na+ + 2e-= Ni +2 NaCl
知识点
某小组为研究电化学原理,设计如右图装置。下列叙述不正确的是
正确答案
解析
略
知识点
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由
空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g) + O2(g) 
2SO2(g) + O2 (g) 
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为________。
② 随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到
平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是
_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e. 在其他条件不变时,升高体系温度
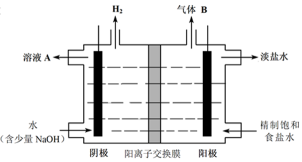
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。下图是氯碱工业中电解饱和食盐水的原理示意图。
① 电解饱和食盐水的化学方程式是 。
② 用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③ 用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是
。
正确答案
见解析。
解析
(1) SO2 + H2O = H2SO3 2 H2SO3 + O2 2H2SO4
(2)① NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1
② 减小
(3) ① 2
② b c
(4)① 2NaCl + 2H2O
② SO2 + OH- =HSO3- (或SO2 + 2OH- =SO32- + H2O)
③ SO2 + Cl2 + H2O =4H+ + SO42- + 2Cl-
知识点
扫码查看完整答案与解析