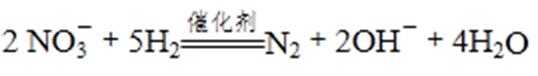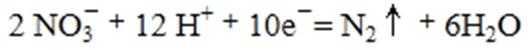- 电极反应和电池反应方程式
- 共352题
氮氧化合物是大气污染的重要因素。
(1)汽车排放的尾气中含NO,生成NO的反应的化学方程式为 。
(2)采取还原法,用炭粉可将氮氧化物还原。
已知: N2(g)+O2(g)===2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
则反应 C(s)+2NO(g)===CO2(g)+N2(g) ΔH=________kJ·mol-1。
(3)将NO2变成无害的N2要找到适合的物质G与适当的反应条件,G应为 (填写“氧化剂”或“还原剂”)。下式中X必须为无污染的物质,系数n可以为0。
NO2 + G 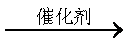
下列化合物中,满足上述反应式中的G是 (填写字母)。
a.NH3
b.CO2
c.SO2
d.CH3CH2OH
(4)治理水中硝酸盐污染的方法是:
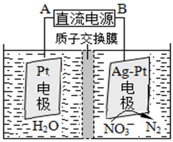
①催化反硝化法中,用H2将NO还原为N2,一段时间后, 溶液的碱性明显增强。则反应的离子方程式为: 。
②在酸性条件下,电化学降解NO的原理如下图,电源正极为: (选填“A”或“B”),阴极反应式为: 。
正确答案
见解析。
解析
(1)
(2) -574.1
(3)还原剂,ad
(4)①
②A
知识点
铜锌原电池装置(见下图),下列分析正确的是
正确答案
解析
略
知识点
海水是巨大的化学资源宝库。
Ⅰ.从海水中可以提取氯、溴、碘等卤族元素。
(1)Cl2的电子式是 。
(2)已知:X2 (g)+H2(g)
右图表示平衡常数K与温度t的关系。
①ΔH 表示X2与H2反应的焓变,ΔH 0。(填“>”、“<”或“=”)
② 曲线a表示的是 (填“Cl2”、“Br2”或“I2”)与H2反应时K与t的关系。
Ⅱ.海水淡化具有广泛的应用前景,淡化前需对海水进行预处理。
(1)通常用明矾[K2SO4·Al2(SO4)3·24H2O]作混凝剂,降低浊度。明矾水解的离子方程式是 。
(2)用下图所示NaClO的发生装置对海水进行消毒和灭藻处理。
① 装置中由NaCl转化为NaClO的化学方程式是 。
② 海水中含有Ca2+、Mg2+、HCO3-等杂质离子,处理过程中装置的阴极易产生水垢,其主要成分是Mg(OH)2和CaCO3。生成CaCO3的离子方程式是 。
③ 若每隔5-10 min倒换一次电极电性,可有效地解决阴极的结垢问题。
试用电极反应式并结合必要的文字进行解释 。
正确答案
见解析。
解析
Ⅰ.(1) 
(2)① <(2分);
② Cl2(2分)。
Ⅱ.(1)Al3++3H2O
(2)① 
2NaOH+Cl2=NaClO+NaCl+H2O ;
② Ca2++HCO3-+OH-=CaCO3↓+H2O ;
③ 阴极结垢后倒换电极电性,阴极变为阳极,其电极反应为:2Cl--2e-=Cl2↑,产生的氯气与水发生反应:Cl2+H2O=HCl+HClO,使该电极附近溶液呈酸性,从而将Mg(OH)2和CaCO3溶解而达到除垢的目的。
知识点

(1)电解饱和NaCl溶液获得
(2)为便于储存,要将氯气液化[
(3)液氯储存区贴有的说明卡如下(部分):
① 用离子方程式表示“泄漏处理”中NaHSO3溶液的作用_______。
② 若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③ 氯气含量检测仪工作原理示意图如下:
Cl2在Pt电极放电的电极反应式是_______。
(4)质量标准要求液氯含水量(以1 g氯气含水的质量计)<0. 4 mg,含水量超标会严重腐蚀钢瓶。液氯含水量的测定装置如下图所示:
(已知:P2O5 + 3H2O = 2H3PO4;Cl2与P2O5不反应。)
① 用离子方程式说明c装置的作用_______。
② 检测液氯的含水量,根据上图,需要测定的数据是_______。
正确答案
见解析。
解析
(1)2NaCl + 2H2O 电解 2NaOH + H2↑+ Cl2↑
(2)降温 (或加压)
(3)① HSO3- + Cl2 +H2O == SO42- + 2Cl- + 3H+
② 铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③ Cl2 + 2e- + 2Ag+ == 2AgCl
(4)① Cl2 + 2OH- == Cl- + ClO- + H2O
② 分别测定通液氯样品前后a、c 的质量
知识点
电化学在日常生活中用途广泛,图甲是镁一次氯酸钠燃料电池,电池总反应为:Mg+ClO-+H2O=Cl-+Mg(OH)2
正确答案
解析
略。
第Ⅱ卷
知识点
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
Ⅰ.改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应如下:
C(s)+H2O(g)
(1)煤气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为 。
(已知:H2S:Ka1=1.3×10-7 ,Ka2=7.1×10-15 ;H2CO3:Ka1=4.4×10-7 ,Ka2=4.7×10-11。)
(2)现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中发生如下反应:CO(g)+H2O(g)
该反应的
Ⅱ.压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO(g)
②CH4(g) +2NO2(g)
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示如图,NiO电极上NO发生的电极反应式: 。
(4)收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V (NO)︰V(NO2)= 。
(5)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生①②两个反应:并在t秒时测定其中NOx转化率,绘得图象如图所示:
从图中可以得出的结论是
①
②
正确答案
Ⅰ(1)CO32- + H2S = HCO3-+ HS-
(2) < ; <
Ⅱ(3)NO–2e-+ O2-═ NO2
(4)1:1
(5)①相同温度下NO转化效率比NO2的低
②在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
解析
略
知识点
某装置如图所示,该装置工作过程中,下列判断错误的是
正确答案
解析
略。
知识点
糕点包装中常用的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是
正确答案
解析
略
知识点
SO2、NO是大气污染物。吸收SO2 和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如下图所示。
①下列说法正确的是 (填字母序号)。
a.pH=8时,溶液中c(HSO3-) < c(SO32-)
b.pH=7时,溶液中c(Na+) =c(HSO3-)+c(SO32-)
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制
在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式 。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成Ce4+的电极反应式为 。
②生成Ce4+从电解槽的 (填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
正确答案
见解析。
解析
(1)SO2 + OH-=== HSO3-
(2)①a、c
②HSO3- 在溶液中存在电离平衡:HSO3-
Ca2++SO32-=== CaSO3↓使电离平衡右移,c(H+)增大。
(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+
(4)①Ce3+- e-=== Ce4+
② a
(5)243a(242a、244a、5600a /23都给分)
知识点
碳和硅属于同主族元素,在生活生产中有着广泛的用途。
(1)甲烷可用作燃料电池,将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池,通入CH4的一极,其电极反应式是_______;
CH4催化还原NOX可以消除氮氧化物的污染,有望解决汽车尾气污染问题,反应如下:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则NO2被甲烷还原为N2的热化学方程式为_______。
(2)已知H2CO3
HCO3-
HA
请依据以上电离平衡常数,写出少量CO2通入到NaA溶液中的离子方程式_______。
(3) 在T温度时,将1.0molCO2和3.0molH2充入2L密闭恒容器中,可发生反应的方程式为CO2 (g) + 3H2(g) 
(4)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英(SiO2)与焦炭在高温的氮气流中反应生成,已知该反应的平衡常数表达式K=[c(CO)]6/[c(N2)]2,若已知CO生成速率为v(CO)=6mol·L-1·min-1,则N2消耗速率为v(N2)=_______;该反应的化学方程式为_______。
正确答案
(1) CH4-8e-+ 10OH-=CO32-+ 7H2O;CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867kJ·mol-1
(2) CO2+ A-+ H2O = HCO3-+ HA
(3) 200(1-a)%或2(1-a)×100%或(2-2a)×100%;64/2187 L/mol
(4) 2mol·L-1·min-1;3SiO2+6C+ 2N2
解析
略。
知识点
扫码查看完整答案与解析