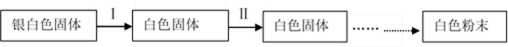- 电极反应和电池反应方程式
- 共352题
金属及其化合物在生活、科研、生产中有着重要的作用。
(1)皮肤粘上高锰酸钾形成的黑斑很久才能消除,如果用H2C2O4(乙二酸为二元弱酸)的稀溶液洗涤,黑斑可以迅速褪去,写出该反应的离子方程式________。
(2)下图为某蓄电系统的示意图。反应原理为:2Na2S2+NaBr3
当蓄电池放电时,Na+的移动方向是从________到________(填a、b),电极b的电极反应式为________。用该电池做电源,用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu2(OH)2CO3后恰好恢复到电解前的状态(不考虑CO2溶解),电解池的阳极反应为________,整个过程中转移的电子数目________。
(3)向含有Ca2+、Mn2+的溶液中加入NH4HCO3,能够生成MnCO3沉淀,写出生成沉淀的离子方程式________。剩余溶液中
正确答案
(1)2MnO4-+5H2C2O4+6H+=2Mn2++5CO2↑+8H2O
(2)ab;Br3-+2e-=3Br-;4OH--4e-=2H2O+O2 ↑;0.6Na或3.612×1023
(3)Mn2++2HCO3-=MnCO3↓+CO2+H2O;500
解析
略。
知识点
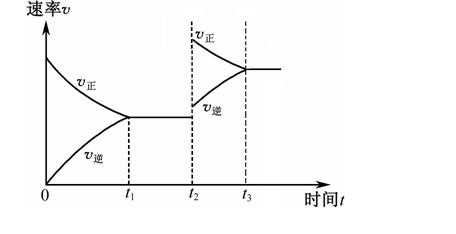
25.(1)一定温度下,向某容积固定的密闭容器中加入适量(NH4)2S固体,发生如下反应:
① (NH4)2S(s) 
② H2S(g) 
达到平衡时测得H2S和H2物质的量浓度分别为4 mol·L-1和1mol·L-1。则反应①的化学平衡常数K= 。
(2)25℃时,向20 mL 0.1mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,当NaOH溶液分别加到:①10 mL、②20 mL、③c (Na+)=c (CH3COO-)、④40 mL时,下列说法正确的是 。(填序号)
A.①中溶液显酸性,则c(Na+)>c(CH3COOH)
B.②中存在c (CH3COOH)+ c (CH3COO-)=0.05mol·L-1
C.③中混合溶液体积大于40 mL
D.④中水电离出的c(H+)最大
(3)密闭容器中发生下列反应:A(g)+B(g) 
(4)已知1.6 g液态甲醇在室温时完全燃烧放出的热量为68.4 kJ,则该条件下甲醇燃烧的热化学方程式为 。
若将甲醇的燃烧反应设计成原电池装置,能量的利用率会更高,当电解质溶液为酸性时,该电池负极的电极反应式为 。
(5)室温时,Ksp(CaCO3)=4.96×10-9,Ksp(MgCO3)=6.82×10-6。含有MgCO3沉淀的MgCl2溶液中,已知c(Mg2+)=0.2 mol · L-1,如果加入等体积的CaCl2溶液,若要产生CaCO3沉淀,加入CaCl2溶液的物质的量浓度最小约为 。
正确答案
(1)400
(2)AB
(3)
(4)2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H= -2736kJ·mol-1
CH3OH-6e-+H2O=CO2+6H+
(5)1.45×10-4mol · L-1
解析
略
知识点
下图为两个原电池装置图,由此判断下列说法错误的是
正确答案
解析
略。
知识点
切开的金属Na暴露在空气中,其变化过程如下:
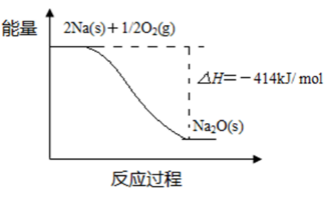
(1)反应Ⅰ的反应过程与能量变化的关系如下:
① 反应Ⅰ 是 反应(填“放热”或“吸热”),判断依据是 。
② 1 mol Na(s)全部氧化成Na2O(s)的热化学方程式是 。
(2)反应Ⅱ是Na2O与水的反应,其产物的电子式是 。
(3)白色粉末为Na2CO3。将其溶于水配制为0.1 mol/L Na2CO3溶液,下列说法正确的是 (填字母)。
a.升高温度,溶液的pH降低
b.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3)
c.加入少量NaOH固体,c (CO32―)与c (Na+)均增大
d.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+)
(4) 钠电池的研究开发在一定程度上可缓和因锂资源短缺引发的电池发展受限问题。
① 钠比锂活泼,用原子结构解释原因_______。
② ZEBRA 电池是一种钠电池,总反应为NiCl2 + 2Na 
正确答案
见解析。
解析
(1)①放热 反应物总能量高于生成物总能量
② Na(s)+1/4O2(g)=1/2Na2O(s) △H=-207 kJ/ mol
(2)
(3)b c
(4)① 最外层电子数相同,随着核电荷数增加,原子半径逐渐增大,金属性增强。
② NiCl2+ 2Na+ + 2e-= Ni +2 NaCl
知识点
某小组为研究电化学原理,设计如右图装置。下列叙述不正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析