- 电极反应和电池反应方程式
- 共352题
工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。下列说法中正确的是
正确答案
解析
略。
知识点
已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系中SO3的百分含量和温度的关系如右图所示(曲线上点均为平衡状态)。由图可知:
①2SO2(g) + O2(g)
②若温度为T1时,反应进行到状态D时,v(正) v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为 、 ;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO 
(3)有人设想用下图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为 ;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为 L/min(标准状况)。
正确答案
见解析。
解析
(1) ① < ; 向左; ② > ;
③ SO2+H2O+2NH3 = (NH4)2SO3 、
(NH4)2SO3+H2SO4 = (NH4)2SO4+SO2↑+H2O ;
④ (NH4)3PO4(或(NH4)2HPO4 、NH4H2PO4);
(2)使CO与NO反应,生成可参与大气生态环境循环的无毒气体;
(3)① CO2+6H++6e-= CH3OH+H2O ; ② 2240 。
知识点
甲、乙、丙3个烧杯中分别装有稀H2SO4、CuCl2溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的两根石墨棒C1、C2插入乙,把分别与直流电源正、负极相连的石墨棒C3、铁片插入丙。则下列叙述正确的是
正确答案
解析
略
知识点
滴有酚酞和氯化钠试液的湿润滤纸分别做甲乙两个实验,能发现附近变成红色的电极是

甲 乙
正确答案
解析
略
知识点
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由
空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是__________。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g) + O2(g) 
2SO2(g) + O2 (g) 
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
① 写出NO2和SO2反应的热化学方程式为________。
② 随温度升高,该反应化学平衡常数变化趋势是________。
(3)提高2SO2 + O2
① T温度时,在1L的密闭容器中加入2.0 mol SO2和1.0 mol O2,5 min后反应达到
平衡,二氧化硫的转化率为50%,该反应的平衡常数是_______。
② 在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是
_________(填字母)。
a.温度和容器体积不变,充入1.0 mol He
b.温度和容器体积不变,充入1.0 mol O2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e. 在其他条件不变时,升高体系温度
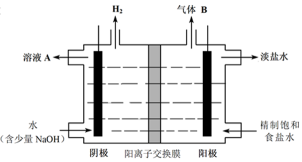
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。下图是氯碱工业中电解饱和食盐水的原理示意图。
① 电解饱和食盐水的化学方程式是 。
② 用溶液A吸收含二氧化硫的废气,其反应的离子方程式是 。
③ 用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是
。
正确答案
见解析。
解析
(1) SO2 + H2O = H2SO3 2 H2SO3 + O2 2H2SO4
(2)① NO2(g) + SO2(g) = SO3(g) + NO(g) △H = -41.8 kJ·mol-1
② 减小
(3) ① 2
② b c
(4)① 2NaCl + 2H2O
② SO2 + OH- =HSO3- (或SO2 + 2OH- =SO32- + H2O)
③ SO2 + Cl2 + H2O =4H+ + SO42- + 2Cl-
知识点
扫码查看完整答案与解析