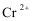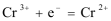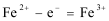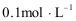- 电极反应和电池反应方程式
- 共352题
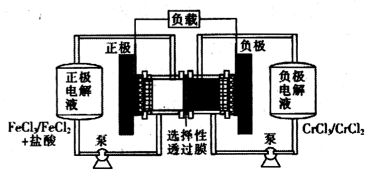
13.铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如图所示,工作原理为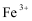
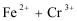
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.甲醇又称“木精”,是重要的溶剂和基本有机原料。工业上常以CO和H2为原料合成甲醇。
(1)已知每1g液态甲醇不完全燃烧生成一氧化碳和液态水时放出13.8kJ热量,写出甲醇不完全燃烧的热化学方程式:__________________。
(2)工业上常利用反应:




A.1~1.5 B.2.5~3 C.3.5~4.5
(3)制甲醇所需要的氢气,可用下列反应制取:
150℃时,在容积为2L的恒温恒容密闭容器中充入1 mol CO和2 mol H2O(g),反应达到平衡后测得H2的体积分数为25%。
① 平衡时CO的转化率为_________。
②150℃下,若起始时充入

(4)某研究小组设计了如图所示的原电池装置,向导管中通入物质的量之比为1:1的CO和

① 电池工作一段时间后,电解质溶液的pH_________(填“增大”、“减小”或“不变”)。
②电池工作一段时间后,测得电解质溶液增重6.2g(不考虑未反应气体的溶解),则负极参加反应的气体质量为_________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.加碘食盐中含有碘酸钾(

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
依据上图完成下列问题:
(1)在电解过程中,阴极上生成气体的电子式为 。
(2)精制过程中除去阳离子中的Ca2+、Mg2+等杂质,除去Mg2+的离子方程式为 。
(3)精制过程要除去SO42-,可选择下列溶液中的 (填字母序号)
a. Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(4)在实际生产中也可以用BaCO3除去SO42-(已知溶解度BaSO4<BaCO3),试用平衡移动原理加以解释: 。
(5) 脱盐工作中,利用NaOH和NaCl在溶解度上的差异,通过蒸发、冷却、 、 (填操作名称)而制得50%的NaOH溶液。
(6)写出电解饱和食盐水的离子方程式:
正确答案
(1)H:H
(2)Mg2++2OH-=Mg(OH)2↓
(3)ac
(4)由于BaSO4比BaCO3的溶解度小,促使BaCO3(s)Ba2+(aq)+ (aq)
平衡正向移动,生成更难溶的BaSO4沉淀。
(5)结晶、过滤
(6)
解析
解析已在路上飞奔,马上就到!
知识点
27.最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)上述流程中碳酸钾溶液所起的作用
(2)分解池中反应的化学方程式为( );
(3)在合成塔中,若有4.4k
(4)从平衡移动原理分析,低温有利于原料气的转化,实际生产
(5)图13是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为:
正确答案
(1)富集空气中的

(2)
(3)
(4)保证有较快的反应速率,提高生产率(能答出与速率相关的答案即可)
(5)甲醇;正;
解析
解析已在路上飞奔,马上就到!
知识点
11. 综合利用

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27. W、Q、R、X、Y、Z六种原子序数依次递增的主族元素。已知W、Y的单质在常温下是气体;
(1)图为元素周期表的一部分,请在图中用元素符号标明元素Z的位置。
(2)
(3) 
(4)用电子式表示WY分子的形成过程( );由W、Q两种元素组成的16电子分子的结构式为( )。
(5)用惰性电极电解熔融的RY晶体时,阴极的电极反应式为( ) 。
(6)101kPa时,X的单质在氧气中完全燃烧生成

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.某储能电池的原理如图所示,溶液中
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.甲醇来源丰富,价格低廉,是一种重要的化工原料,有着非常重要、广泛的用途。工业上通常用水煤气在恒容、催化剂和加热的条件下生产甲醇,其热化学方程式为:2H2(g)+CO(g)
(1)该反应的平衡常数表达式为:K= ,如升高温度,K值将 (填:增大、减小或不变)。
(2)以下各项不能说明该反应达到平衡状态的是 .
(3)在2100C、2400C和2700C三种不同温度、2 L恒容密闭容器中研究合成甲醇的规律。
(4)某兴趣小组设计了如图所示的甲醇燃料电池装置。
② 该电池工作时,正极是 极(填“a”或“b”);
②该电池负极反应的离子方程式为 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.已知:中学化学所学的A.D、E.G四种单质和X. Y.Z三种重要化合物之间有如右图所示的转化关系。
在常温常压下,X是无色无味的液体,Y是黑色晶体,Z的水溶液是一种弱酸,反应(1)不能在玻璃仪器中进行。请推断回答下列问题:
(1)写出X的电子式____ ;
(2)反应(1)的化学方程式____ ;
(3)过量的G单质投入某稀HN03溶液中加热,放出NO气体,请写出这一反应的离子方程式_______________:
(4)在(3)所得溶液中加入过量NaOH溶液,观察到的实验现象是____;
(5)将单质G与金属Al用导线连接插入盛有足量NaOH溶液的同一烧杯中,在外线路中测得有电流产生,请写出该原电池负极的电极反应式:_______。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析