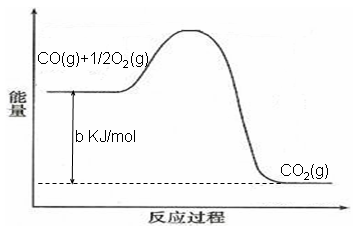
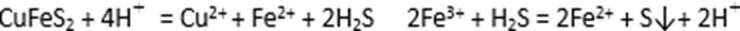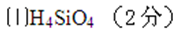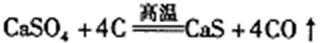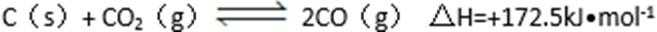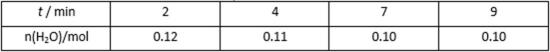- 电极反应和电池反应方程式
- 共352题
请从36~38题中任选一题作答
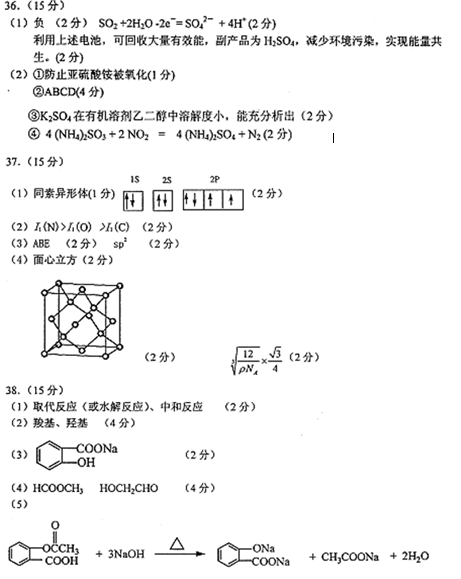
36.[化学—选修:化学与技术]
SO2.NO是大气污染物。吸收SO2 和NO,获得

(1)装置Ⅰ中生成
(2)含硫各微粒(


①下列说法正确的是( )(填字母序号)。
a.pH=8时,溶液中
b.pH=7时,溶液中
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:( )。
(3)装置Ⅱ中,酸性条件下,NO被

(4)装置Ⅲ的作用之一是再生
①生成
②生成
(5)已知进入装置Ⅳ的溶液中,


37.[化学—选修:物质结构与性质]
在5-氨基四唑(
(1)基态Ga原子的电子排布式可表示为( );
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为( );在1mol 5-氨基四唑中含有的σ键的数目为( )
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的 空间构型为( )。
②以四氯化钛.碳化钙.叠氮酸盐作原料,可以生成碳氮化钛化合物.其 结 构是用碳原子取代氮化钛晶胞(结构如上图示)顶点的氮原子,这种碳氮化钛化合物的化学式为( )。
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 ( )。(填写元素符号)
④ [Ti(OH)2(H2O)4]2+中的化学键有( )。
a.σ键 b.π键 c.离子键 d.配位键
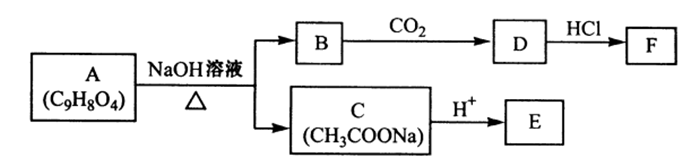
38.[化学—选修:有机化学基础]
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N(部分产物及反应条件已略去)。
(1)生成M、N的反应类型分别是( ),( ); D的结构简式是 ( )。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。C的结构简式是( )。
(3)由苯酚生成A的化学方程式是 ( ) 。B与C反应的化学方程式是( )。
(4)以苯酚为基础原料也可以合成芳香族化合物F。经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31.6%,F完全燃烧只生成

已知:①芳香族化合物F能发生银镜反应,且还能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③分子结构中不存在“-O-O- ”的连接方式。F的结构简式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)某温度下体积为200L的氨合成塔中,测得如下数据:
根据表中数据计算0~2小时内N2的平均反应速率为( )mol·L-1·h-1,若起始时与平衡时的压强之比为a,则N2的转化率为( )(用含a的代表式表示)
(2)希腊阿里斯多德大学的George Mamellos和Michael Stoukides,发明了一种合成氨的新方法(Science, 2, Oct, 1998, p98),在常压下,把氢气和用拟气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和用氦气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式为( )。
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图)

(4)合成塔中反应的原料利用率不是很高,所以在工业采取气体循环的流程。即从合成塔出来的气体通过降低温度而使氨气分离出来。这种分离物质的方法其原理类似于下列哪种方法( )(填编号)
①过滤 ②蒸馏 ③渗析 ④萃取
理由是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%
(1)用于净化汽车尾气的反应为:
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率
D.提高尾气净化效率的最佳途径是使用高效催化剂
(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。镍与CO反应的化学方程式为
则用SO2除去CO的热化学方程式为_____________________________________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是: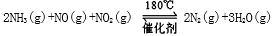
(4)利用ClO2 氧化氮氧化物反应过程如下: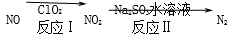

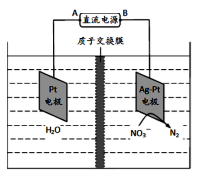
(5)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。其原理如下图所示。
电源负极为( )(填A或B),阴极反应式为( );若电解过程中转移了2mol电子,则质子交换膜左侧极室电解液的质量减少( )克。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
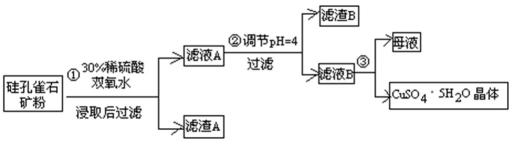
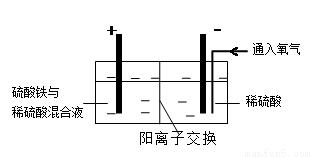
28.硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为
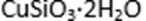
请回答下列问题:
(1)完成步骤①中稀硫酸与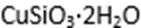
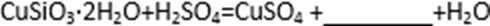
(2)步骤②调节溶液pH选用的最佳试剂是( )
A. CuO B. MgO C. FeCO3 D.
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
由上表可知:当溶液pH=4时,不能完全除去的离子是( )。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到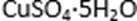
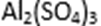
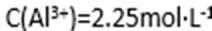
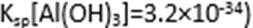
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+ Cu2+(水相)
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是( )(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是( ) 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.以氨作为燃料的固体氧化物(含有
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下图表示镁一次氯酸钠燃料电池工作原理。下列叙述错误的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
36.请从36~38题中任选一题作答
36.【化学——选修2:化学与技术】
近年来,为提高能源利用率,西方提出共生系统。特指为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的( )极(填“正”或“负”),负极反应式为( )。用这种方法处理SO2废气的优点是____
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
①生产中,向反应II的溶液中加入适量还原性很强的对苯二酚等物质,其目的是( )。
②下列有关说法正确的是( )。
A.反应I中需鼓人足量空气,以保证二氧化硫充分氧化生成硫酸钙。
B.反应Ⅲ中发生反应的化学方程式为
C.反应,IV需控制温度在60~70℃,目的之一是减少碳酸氢铵的分解。
D.反应V中的副产物氯化铵可用作氮肥。
③反应V中选用了40%的乙二醇溶液,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液原因是( )。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:( )。
37.【化学——选修3:物质结构与性质】
下图分别是金刚石、石墨、足球烯和碳纳米管的结构示意图。图中小黑点或小黑圈均代表碳原子。
(1)四种物质互称为 ( )。写出碳原子的基态电子排布图 ( )。
(2)试比较:第一电离能I1(C)、I1(N)、I1(O)由大到小的顺序为( ) 。
(3)石墨中存在的作用力有( )。A:σ键 B:π键 C:氢键 D:配位键 E:分子间作用力石墨中碳原子采取的杂化方式是 ( )。
(4)仔细观察图A金刚石结构,有人从中找出它的晶胞结构是碳原子位于立方体的所有顶点及面心处,将立方体切割成8个小立方体,在其中4个互不相邻的立方体体心各有一个碳原子。请写出金刚石属于晶胞,在方框中画出一个晶胞结构示意图:
若金刚石的密度为ρg·cm-3,试计算碳原子的半径为( )cm。
38.【化学——选修5:有机化学基础】
A为药用有机物,从A出发可发生下图所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
请回答:
(1)A转化为B、C时,涉及到的反应类型有( ) 、( ) 。
(2)F中所含官能团的名称是 ( )、( );
(3)D的结构简式为 ( )。
(4)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,在核磁共振氢谱中,Q有两组峰,R有三组峰,Q、R的结构简式为Q ( )、R ( ) 。
(5)A在加热条件下与NaOH溶液反应的化学方程式为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26. 碳及其化合物有广泛的用途。
(1)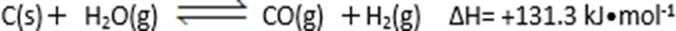
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,
则
(3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为( ) 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:



正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11. 用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.电化学化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,下列关于该电池描述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析