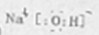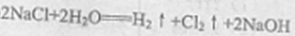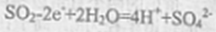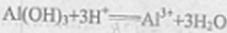- 电极反应和电池反应方程式
- 共352题
28. 



(1)250℃时,以镍合金为催化剂,向4 L容器中通入

①此温度下该反应的平衡常数K=__________
②已知:
反应
(2)以二氧化钛表面覆盖


①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是( )
②为了提高该反应中
③将
(3)

a. 可在碱性氧化物中寻找
b. 可在ⅠA、ⅡA族元素形成的氧化物中寻找
c. 可在具有强氧化性的物质中寻找
②










(4)利用反应A可将释放的


正确答案
解析
解析已在路上飞奔,马上就到!
知识点
31.一定条件下,在体积为3 L的密闭容器中反应:CO(g)+ 2H2(g)
(1)该反应的平衡常数表达式K= ( );根据图,升高温度,K值将( )(填“增大”、“减小”或“不变”)。
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 ( )(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是( )(填字母)。
a、CO、H2、CH3OH的浓度均不再变化 b、混合气体的密度不再改变
c、混合气体的平均相对分子质量不再改变 d、 v生成(CH3OH)= v消耗(CO)
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是( )(填字母)。
a、c(H2)减少 b、正反应速率加快,逆反应速率减慢
c、CH3OH 的物质的量增加 d、重新平衡时c(H2)/ c(CH3OH)减小
(5)根据题目有关信息,请在以下坐标图中标示出该 化学反应过程的能量变化(标明信息)。
(6)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH +3O2+4OH- = 2CO32- + 6H2O,该电池中负极上的电极反应式是:2CH3OH–12e-+16OH-= 2CO32-+ 12H2O ,则正极上发生的电极反应为:( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
15.砷(As)广泛分布于自然界,其原子结构示意图是
(1)砷位于元素周期表中( )族,其气态氢化物的稳定性比NH3 ( )(填“强”或“弱”)。
(2)砷的常见酸性氧化物有As2O3和As2O5,根据下图写出As2O5分解为As2O3的热化学方程式:( )。
(3)砷酸盐可发生如下反应:AsO


① A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转。此时C2上发生的电极反应式为 ( ) 。
② 一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针( )(填“不动”、“向左偏”或“向右偏”)。
正确答案
(1)
(2)
(3)① 
解析
解析已在路上飞奔,马上就到!
知识点
27.二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
Ⅰ(1)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为
电池的正极反应式为( )
Ⅱ某化学研究性学习小组拟从废旧干电池中回收二氧化锰制取碳酸锰。
①将干电池剖切、分选得到黑色混合物(主要成分为
②将上述固体按固液体积比2:9加入浓盐酸、加热,反应完全后过滤、浓缩。
③向上述溶液中加入
(2)在第②步中,将上述固体与浓盐酸混合的目的是( )
(3)有人认为,将第③步中的 


Ⅲ 湿法炼锰即电解硫酸锰溶液法。电解锰的生产过程分为化合浸取、氧化净化及沉淀除杂、产品回收。其生产工艺流程如下:
已知:①菱锰矿中主要成份是碳酸锰,主要杂质是
②生成氢氧化物的pH如下表:(若某离子浓度小于等于 
③有关难溶氢氧化物和硫化物

(4)菱锰矿粉与硫酸反应的化学方程式是( )。
(5)使用氨水的目的是调节pH值在( )之间(填pH范围,精确到小数点后1位数字)。在“浸出液”中加入
(6)电解槽中使用的是惰性电极板,电解反应方程式为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
31. Ⅰ.已知:4Al(s)+3O2(g) = 2Al2O3(s) △H=-2834.9KJ•mol-1
写出铝与氧化铁发生铝热反应的热化学方程式( ) 。
Ⅱ.在2L密闭容器内,800℃时反应:
(1) 写出该反应的平衡常数表达式:K= ( ); 用

(2)下列研究目的和示意图相符的是( )。
III.科学家制造出一种使用固体电解质的高效燃料电池。一个电极通入空气,另一个电极通入燃料蒸汽。其中固体电解质是掺杂了


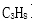
(1)电池的负极反应式为( );
(2)放电时固体电解质里的
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.(1)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。现将

①若HA为HCN,该溶液显碱性,则溶液中c(CN—)( )c(Na+)(填“<”、“=”或“>”),你得出该结论的依据是( )。
②若HA为CH3COOH,该溶液显酸性。溶液中所有的离子按浓度由大到小排列的顺序是( )
(2)二氧化氯(ClO2)为一种黄绿色气体,
①图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:( )。
②电解一段时间,当阴极产生的气体体积为336 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为( )mol;用平衡移动原理解释阴极区pH增大的原因( )。
(3)25℃时,



正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.现有A、B、C、D四种原子序数依次递增的短周期元素,E是常见的金属元素。已知A的最外层只有一个电子,B的最外层电子数是次外的三倍,C与A的最外层电子数相同,D与B是同主族元素。化合物甲是由A、B、C三种元素组成,化合物乙B、D、E三种元素组成,甲乙两种溶液混合有蓝色沉淀产生。化合物丙和丁都由B、C、D三种元素组成,且丙的相对分子质量比丁大16。请回答下列问题。
(1)画出C的原子结构示意图( ),指出D在周期表中的位置( ) 。
(2)写出丙和丁的化学式,丙( ),丁( ) 。鉴别丙的阴离子的方法是( ) 。
(3)写出以Mg、Al为电极材料,以甲为电解质溶液所组成的原电池,负极的电极反应式( ) 。
(4)若用石墨为电极,在250C时,电解200mL乙的溶液,当阴极增重6.4g,则反应后溶液的PH= ( ) (设反应后溶液的体积仍为200mL);若以铜作电极,电解乙的水溶液,当外电路通过0.2mol电子时,理论上两极质量相差( ) g。
正确答案
(1)
(2)丙:


(3)
(4)PH=0;12.8g
解析
解析已在路上飞奔,马上就到!
知识点
12.利用右图装置制取Cu2O,乙的总反应化学方程式为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.A、B、C、D、E、F为六种短周期元素。 A、B主族序数之和等于F最高正化合价数;
F原子的最外层电子数等于其周期序数,B原子核内质子数是D原子序数的两倍,且B单质能在
D的某种化合物中燃烧生成黑色和白色两种固体。C的简单阳离子半径大于B的简单阳离子,E
是地壳中含量最丰富的元素。请用化学用语回答下列问题。
(1)B在周期表中的位置为__________________。
(2)DE2的电子式为________________,其形成的晶体类型为________。
(3)工业上冶炼F单质的方法为___________________________________________。
(4)C2E2与DE2反应的化学方程式是______________________________________。
(5)CA与A2E反应后溶液呈碱性且生成A的单质,化学方程式为__________________________。
(6)由B、F的单质作电极与C的最高价氧化物对应水化物的溶液构成原电池,负极电极反应式为________________________________。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素。
①A元素的原子半径在周期表中最小
②B元素的原子最外层电子数是次外层电子数的两倍
③C元素的最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可以形成E2D、E2D2两种离子化合物
⑤G与D两种元素同主族,F、G、H三种元素同周期
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素
(1)写出A、D、E三种元素形成的化合物的电子式 ______;
(2)用惰性电极电解由E与H两元素形成的化合物的水溶液,其化学方程式为 _______;
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是_________,能抑制水电离的是________(各写一种化学式);
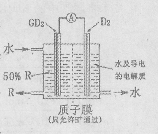
(4)某科研单位依据电化学原理用GD2来制备一种强酸R,装置如右图,电极为含有某种催化剂的多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入GD2的电极为______极,其电极反应式为 __________;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同。回答问题:
①向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是 _____;
②向乙溶液中缓慢滴加过量的丙溶液发生反应的离子方程式为 ________ 、______ 。
正确答案
(1)
(2)
(3)
(4)负
(5)①开始无明显现象,后来产生大量无色气体;
②
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析