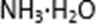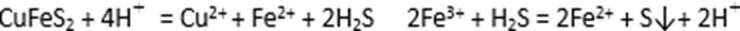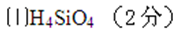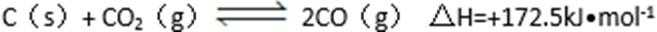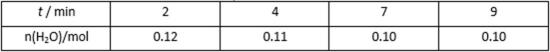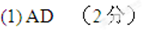- 电极反应和电池反应方程式
- 共352题
请从36~38题中任选一题作答
36.[化学—选修:化学与技术]
SO2.NO是大气污染物。吸收SO2 和NO,获得

(1)装置Ⅰ中生成
(2)含硫各微粒(


①下列说法正确的是( )(填字母序号)。
a.pH=8时,溶液中
b.pH=7时,溶液中
c.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:( )。
(3)装置Ⅱ中,酸性条件下,NO被

(4)装置Ⅲ的作用之一是再生
①生成
②生成
(5)已知进入装置Ⅳ的溶液中,


37.[化学—选修:物质结构与性质]
在5-氨基四唑(
(1)基态Ga原子的电子排布式可表示为( );
(2)5-氨基四唑中所含元素的电负性由大到小的顺序为( );在1mol 5-氨基四唑中含有的σ键的数目为( )
(3)叠氮酸钠(NaN3)是传统家用汽车安全气囊中使用的气体发生剂.
①叠氮酸钠(NaN3)中含有叠氮酸根离子(N3-),根据等电子体原理N3-的 空间构型为( )。
②以四氯化钛.碳化钙.叠氮酸盐作原料,可以生成碳氮化钛化合物.其 结 构是用碳原子取代氮化钛晶胞(结构如上图示)顶点的氮原子,这种碳氮化钛化合物的化学式为( )。
③与钛同周期的所有元素的基态原子中,未成对电子数与钛相同的元素有 ( )。(填写元素符号)
④ [Ti(OH)2(H2O)4]2+中的化学键有( )。
a.σ键 b.π键 c.离子键 d.配位键
38.[化学—选修:有机化学基础]
苯酚是一种重要的化工原料。以苯酚为主要起始原料,经下列反应可制得香料M和高分子化合物N(部分产物及反应条件已略去)。
(1)生成M、N的反应类型分别是( ),( ); D的结构简式是 ( )。
(2)已知C的分子式为C5H12O,C能与金属Na反应,C的一氯代物有2种。C的结构简式是( )。
(3)由苯酚生成A的化学方程式是 ( ) 。B与C反应的化学方程式是( )。
(4)以苯酚为基础原料也可以合成芳香族化合物F。经质谱分析F的相对分子质量为152,其中氧元素的质量分数为31.6%,F完全燃烧只生成

已知:①芳香族化合物F能发生银镜反应,且还能发生水解反应;
②F的核磁共振氢谱显示其分子中含有4种氢原子;
③分子结构中不存在“-O-O- ”的连接方式。F的结构简式是( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5化学组成及来源的季节变化研究发现,北京PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%
(1)用于净化汽车尾气的反应为:
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率
D.提高尾气净化效率的最佳途径是使用高效催化剂
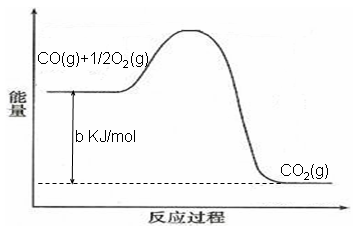
(2)CO对人类生存环境的影响很大,CO治理问题属于当今社会的热点问题。镍与CO反应的化学方程式为
则用SO2除去CO的热化学方程式为_____________________________________。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是: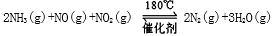
(4)利用ClO2 氧化氮氧化物反应过程如下: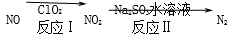

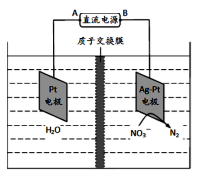
(5)化学在环境保护中起着十分重要的作用,电化学降解法可用于治理水中硝酸盐的污染。其原理如下图所示。
电源负极为( )(填A或B),阴极反应式为( );若电解过程中转移了2mol电子,则质子交换膜左侧极室电解液的质量减少( )克。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
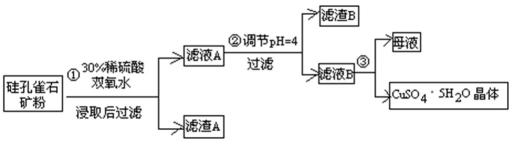
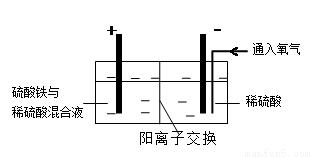
28.硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为
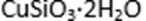
请回答下列问题:
(1)完成步骤①中稀硫酸与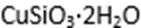
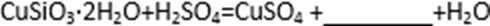
(2)步骤②调节溶液pH选用的最佳试剂是( )
A. CuO B. MgO C. FeCO3 D.
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
由上表可知:当溶液pH=4时,不能完全除去的离子是( )。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到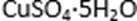
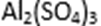
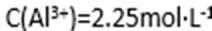
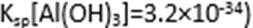
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:2RH(有机相)+ Cu2+(水相)
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是( )(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是( ) 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.以氨作为燃料的固体氧化物(含有
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26. 碳及其化合物有广泛的用途。
(1)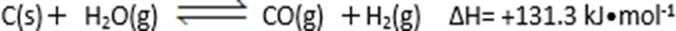
A.升高温度 B.增加碳的用量 C.加入催化剂 D.用CO吸收剂除去CO
(2)又知,
则
(3)CO与H2在一定条件下可反应生成甲醇,甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为( ) 。
(4)在一定温度下,将CO(g)和H2O(g)各0.16 mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:



正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析