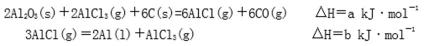- 电极反应和电池反应方程式
- 共352题
13.某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水。当K闭合时,X电极附近溶液先变红。下列分析不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.用Pt做电极,电解含C(Cu2+): C(Na+): C(Cl-)=1:2:4的混合溶液,在任何情况下,阴、阳两极下不可能同时发生的反应是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
36.请从36~38题中任选一题作答
36.【化学—选修2:化学与技术】
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。
已知:①Cu+在酸性溶液中不稳定,可发生自身氧化还原反应;
②当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;
③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中Cu2O发生反应的离子方程式为:______________;
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸盐晶体,该晶体的化学式是______________。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式______________。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式:______________ 。
(4)“循环III”中反萃取剂的主要成分是______________。
37.【化学—选修3:物质结构与性质】
下图所示为血红蛋白和肌红蛋白的活性部分——血红素的结构式。
回答下列问题:
(1)已知铁是26号元素,写出Fe的价层电子排布式 ______________;在元素周期表中,该元素在______________区(填“s”、“p”、“d”、“f”或“ds”)。
(2)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是______________; 血红素中N原子的杂化方式为______________;请在下图的方框内用“→”标出
(3)Fe原子或离子能与一些分子或离子形成配合物。


(4)铁有α、γ、δ三种同素异形体,其晶胞如下图所示,在三种晶体中最邻近的铁原子间距离相同。图2晶胞中所含有的铁原子数为______________,图1和图3中,铁原子配位数之比为______________ 。
38.【有机化学基础】 某制药厂用两种石油裂解气C4H8和C2H4以及
成一种药物K,其合成路线设计如下:
其中G无酸性,H、I有酸性;D可与NaHCO3溶液作用生成气体,并遇FeCl3溶液不显紫色;K的分子式为(C15H16O6)n。请完成下列各题:
(1) 上述过程中属于取代反应的是__________________________。
(2) 写出结构简式:E________________;K__________________。
(3) 写出下列反应的化学方程式:B→C:___________________。H→I:___________________。
(4) 写出Ⅰ的属于链状酯类且其核磁共振氢谱图中有三个吸收峰的同分异构体的结构简式__________________________________(任写3个)。
36.请从36~38题中任选一题作答
37.【化学—选修3:物质结构与性质】
下图所示为血红蛋白和肌红蛋白的活性部分——血红素的结构式。
回答下列问题:
(1)已知铁是26号元素,写出Fe的价层电子排布式 ;在元素周期表中,该元
素在 区(填“s”、“p”、“d”、“f”或“ds”)。
(2)血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大
的顺序是 ; 血红素中N原子的杂化方式为 ;请在下图的方框内用“→”标出
(3)Fe原子或离子能与一些分子或离子形成配合物。


反应过程中,断裂的化学键只有配位键,形成的化学键类型是 。
(4)铁有α、γ、δ三种同素异形体,其晶胞如下图所示,在三种晶体中最邻近的铁原子间距离相同。图2晶胞中所含有的铁原子数为 ,图1和图3中,铁原子配位数之比为 。
38.【有机化学基础】 某制药厂用两种石油裂解气C4H8和C2H4以及
其中G无酸性,H、I有酸性;D可与NaHCO3溶液作用生成气体,并遇FeCl3溶液不显紫色;K的分子式为(C15H16O6)n。请完成下列各题:
(1) 上述过程中属于取代反应的是__________________________。
(2) 写出结构简式:E________________;K__________________。
(3) 写出下列反应的化学方程式:B→C:___________________。H→I:___________________。
(4) 写出Ⅰ的属于链状酯类且其核磁共振氢谱图中有三个吸收峰的同分异构体的结构简式__________________________________(任写3个)。
正确答案
36.【化学—选修2:化学与技术】
现代社会中铜在电气、交通、机械和冶金、能源及石化工业、高科技等领域有广泛的应用。某铜矿石含氧化铜、氧化亚铜、三氧化二铁和脉石(SiO2),现采用酸浸法从矿石中提取铜,其工艺流程图如下。其中铜的萃取(铜从水层进入有机层的过程)和反萃取(铜从有机层进入水层的过程)是现代湿法炼铜的重要工艺手段。

太低时,可用硫酸和硫酸铁的混合液浸出铜;③反萃取后的水层2是硫酸铜溶液。
回答下列问题:
(1)矿石用稀硫酸处理过程中Cu2O发生反应的离子方程式为: ;
(2)“循环I”经多次循环后的水层1不能继续循环使用,但可分离出一种重要的硫酸
盐晶体,该晶体的化学式是 。若水层1暴露在空气中一段时间后,可以得到另一种重要的硫酸盐,写出水层1暴露在空气中发生反应的离子方程式 。
(3)写出电解过程中阳极(惰性电极)发生反应的电极反应式: 。
(4)“循环III”中反萃取剂的主要成分是 。
正确答案
正确答案
请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题做答。
36.氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
(1)该流程中可以循环的物质是( ) 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式( ),若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果( )。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是( ),E电极的名称是( )。电解总反应的离子方程式为 ( ) 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 ( ) 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为 ( ) 。
38.化合物G是一种医药中间体,常用于制备抗凝血药。可以通过下图所示的路线合成:
请回答下列问题:
(1)B→C的转化所加的试剂可能是( ),C+E→F的反应类型是 ( ) 。
(2)有关G的下列说法正确的是( )。
A.属于芳香烃 B.能与FeCl3溶液发生显色反应
C.可以发生水解、加成、氧化、酯化等反应 D.1mol G最多可以跟4mol H2反应
(3)E的结构简式为( )。
(4)F与足量NaOH溶液充分反应的化学方程式为( )。
(5)写出同时满足下列条件的E的同分异构体的结构简式 ( ) 。
①发生水解反应②与FeCl3溶液能发生显色反应③苯环上有两种不同化学环境的氢原子
(6)已知:酚羟基一般不易直接与羧酸酯化。而苯甲酸苯酚酯(
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) 
①0~10min内,NO的平均反应速率v(NO)=( ),T1℃时,该反应的平衡常数K=( );
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是( )(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q( )0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是( )(填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
请写出该电池正极反应式 ( );常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH=( )(不考虑溶液体积的变化)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析