- 电极反应和电池反应方程式
- 共352题
10.图6为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2+M
已知:6NiOOH+NH3+H2O+OH-
下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
5.下列有关原电池和电解池的叙述中,正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.铁的单质和化合物在实验和实际生产中都有重要作用。
Ⅰ.某同学将Cl2通入FeCl2和KSCN混合溶液中,现象为:
(1)B装置中反应的化学方程式___________________________。
(2)A中溶液变红的原因是___________________________。
(3)为探究产生现象2的原因,该同学进行如下实验:
①取少量A中黄色溶液于试管加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_________
②取少量A中黄色溶液于试管中,加入过量KSCN溶液,最终得到血红色溶液。
实验说明,Fe3+ 与SCN-生成红色Fe(SCN) 3的反应_________可逆反应(是或不是)。
(4)该同学根据实验猜想,SCN-可能被氯水氧化。查资料得知SCN-的电子式为
离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H+ + CO2 ;
①上述反应中,0.5molSCN-被氧化时转移的电子总数为_________个。
② 若要检验产物中含有SO42-,常用的化学试剂是________(写试剂名称)。
Ⅱ.①高铁电池因原料丰富、绿色环保而倍受关注。Zn-K2FeO4碱性电池的某电极的放电产
物为FeOOH,该极电极为_________极,电极反应式为________________。
②消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化.请说明其原理__________________
正确答案
Ⅰ. (1) 2NaOH + Cl2 =NaCl + NaClO + H2O
(2) Fe2+ 被Cl2氧化产生Fe3+,Fe3+与SCN-反应生成Fe(SCN)3呈红色
(3)① Fe3+ ② 是
(4) ① 8×6.02×1023
②氯化钡溶液、盐酸
Ⅱ.①正 FeO42-+3e-+3H2O=FeOOH+ 5OH-
② Na2FeO4 具有强氧化性,能够杀菌消毒,还原产物Fe3+ 水解生成氢氧化铁胶体能够凝聚水中的悬浮物并能够吸附色素达到净水的目的
解析
解析已在路上飞奔,马上就到!
知识点
20.甲醇是极为重要的有机化工原料,在化工、医药、轻工、纺织及运输等行业都有广泛的应用。可以用CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O(g)
II:CO(g) + 2H2(g)
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:______________________________。
(2)在压强为0.1MPa、温度为300℃条件下,使1molCO与2molH2在催化剂作用下在恒温恒容的容器中发生反应II生成甲醇,下列有关说法正确的是 (填字母序号)。
A.移走CH3OH,平衡正向移动,正反应速率加快
B.反应达平衡后,再加入1molCO与2molH2,CO转化率增大
C.混合气体的密度不变时,说明反应达到平衡
D.平衡后,将容器体积压缩至原来一半,平衡常数K增大
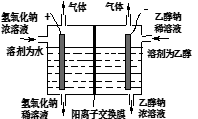
(3)某科研组设计见如图装置,利用电解乙醇和氢氧化钠制取乙醇钠(阳离子交换膜只允许Na+通过)。电解时阳极产成的气体是 ,阴极发生的电极反应式为 。
(4)甲醇对水质会造成一定的污染,可利用Co2(SO4)3氧化除去甲醇,得到CoSO4和一种常见气体。请写出除去甲醇的离子方程式 。
正确答案
(1)CH4(g)+H2O(g) =CH3OH(g) +H2(g)△H=+77.0 kJ/mol
(2)B
(3)O2;CH3CH2OH+2e-=2CH3CH2O-+H2↑
(4)6Co3+ + CH3OH + H2O = CO2↑+ 6Co2+ + 6H+
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析