- 电极反应和电池反应方程式
- 共352题
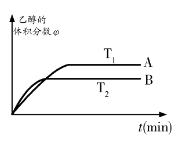
据报道,在一定条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。
(1)CO2和H2合成乙醇的化学方程式为:
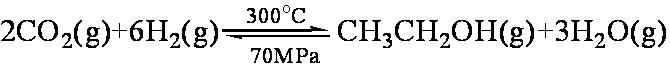
如果只是压强增大,则该反应的化学平衡常数K将 (填:“增大”、“减小”或“不变”);
②从上图可知,该平衡正向的ΔH 0(填“>”、“<”或“=”)。
(2)对于该化学平衡,为了提高H2的转化率,可采取的措施有 。
A.加压
B.升温
C.加催化剂
D.增加CO2的浓度
(3)已知25oC、101 kPa条件下,1 g乙醇燃烧生成CO2和液态水时释放出a kJ热量,请写出该条件下乙醇燃烧热的热化学反应方程式: 。
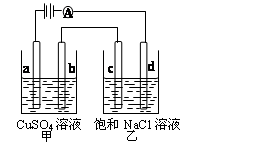
(4)现有甲装置为原电池(a电极通氧气,b电极通乙醇),乙装置为电解池:
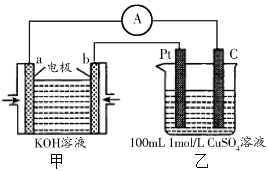
② 若甲中有0.01mol CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为 L 。
正确答案
见解析。
解析
(1)① 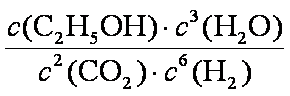
(2)A、D ;
(3)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-46a kJ/mol ;
(4)①C2H5OH-12e-+16OH-=2CO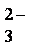
②0.672 。
知识点
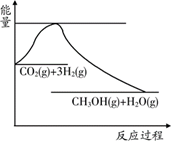
为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:CO2(g) + 3H2(g)
(1)上图表示该反应过程中能量变化,则该反应为 反应(填“吸热”或“放热”),判断依据是 ;
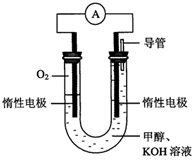
(2)某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置。
①该电池正极的电极反应式为: ;
② 工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为: ;
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH = -1275.6 kJ/mol
② 2CO(g) + O2(g) = 2CO2(g) ΔH = -566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: ;
(4)为了消除污染,在一定条件下,向含有甲醇的废水中加入一定量的稀硝酸,会有N2等物质生成。若参加反应的氧化剂和还原剂的物质的量之比为6∶5,写出该反应的化学方程式 ;在此反应过程中若消耗32 g 甲醇,将转移
mol 电子。
正确答案
见解析。
解析
(1)放热; 生成物总能量低于反应物总能量 ;
(2) ① O2 + 2H2O + 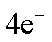
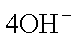
② 2CH3OH + 3O2 + 4KOH = 2K2CO3 + 6H2O ;
(3)CH3OH(l) + O2(g) = CO(g) + 2H2O(l) ΔH =﹣442.8 kJ∕mol ;
(4)5CH3OH + 6HNO3 = 3N2 ↑ + 5CO2 ↑ + 13H2O ; 6 。
知识点
Fe、Cu、Al是常见的金属元素,按要求回答下列问题:
(1)向氯化铜溶液中加入一定量的铁粉和铝粉混合物,充分反应后,下列情况可能出现的是________(填编号)。
A. 溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu
B. 溶液中有Fe2+、Al3+,不溶物为Cu、Fe
C. 溶液中有Fe3+、Al3+,不溶物为Cu
D. 溶液中有Fe2+,不溶物为Cu、Al
(2)将一定质量的铁、铝、铜合金,加入1L 一定物质的量浓度的硝酸中完全溶解,测得溶液中(忽略溶液体积的变化)c(H+)=0.5mol/L,c(Cu2+)=0.3mol/L,c(Al3+)=0.2mol/L,c(NO3-)=2mol/L,则混合物中铁的质量为________。
(3)在硫酸铜溶液中加入碘化钾溶液,有白色沉淀生成,溶液的颜色则由蓝色变为深黄色,经分析证明白色沉淀是碘化亚铜,该反应的离子方程式为________。
(4)Li-Al/FeS是一种可充电电池,电池中用含Li+导电固体作为电解质,在工作过程中Li+的物质的量保持不变,其正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe,则电池的负极反应式为________。充电时,阳极发生反应的物质是________。用该电池作电源,组成如右图所示装置(a、b、c、d均为石墨电极)。电解后向甲中加入适量的________(填物质化学式),可以使溶液恢复到原来状态,当500mL乙溶液的pH为13时,在b极上生成物质的质量为________。
正确答案
(1)ab
(2)5.6g
(3)2Cu2++4I-=2CuI↓+I2
(4)2Li-2e-=2Li+; Li2S、Fe;CuO;1.6g
解析
略。
知识点
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)已知:①2CH3OH(l)+ 3O2(g)= 2CO2(g)+ 4H2O(g)ΔH1 = –1275.6 kJ·mol– 1
②2CO(g)+ O2(g)= 2CO2(g) ΔH2 = –566.0 kJ·mol– 1
③H2O(g)= H2O(l) ΔH3 = –44.0 kJ·mol– 1写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:__________。
(2)生产甲醇的原料CO和H2来源于:CH4(g)+ H2O(g)
① 一定条件下CH4的平衡转化率与温度、压强的关系如图a。则,Pl P2;A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为__________。(填“<”、“>”“=”)
② 100℃时,将1 mol CH4和2 mol H2O通入容积为100 L的反应室,反应达平衡的标志是:__________。
A. 容器内气体密度恒定
B. 单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
C. 容器的压强恒定
D. 3v正(CH4)= v逆(H2)
如果达到平衡时CH4的转化率为0.5,则100℃时该反应的平衡常数K =__________。
(3)某实验小组利用CO(g)、O2(g)、KOH(aq)设计成如图b所示的电池装置,负极的电极反应式为__________。用该原电池做电源,常温下,用惰性电极电解200 mL饱和食盐水(足量),消耗的标准状况下的CO 224 mL,则溶液的pH =__________。(不考虑溶液体积的变化)
(4)氢氧燃料电池的三大优点是:__________、__________、能连续工作。
正确答案
(1)CH3OH(l)+ O2(g)= CO(g)+ 2H2O(l)ΔH = –442。8 kJ·mol– 1
(2)① <; KC> KB >KA;②CD 2.25×10– 4mol2·mol– 2
(3)CO + 4OH– → 
(4)污染少、能量利用率高
解析
略。
知识点
I: 已知在常温常压下:
① 2CH3OH(l)十3O2(g) 2CO2(g)+4H2O(g) △H= -1275.6 kJ·mol—1
② H2O(l) H2O(g) △H=+ 44.0 kJ.mo—1
写出表示甲醇燃烧热的热化学方程式 。
II:磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如下图:
(1)在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”),向Na3PO4溶液中滴入稀盐酸后 ,pH从10降低到5的过程中发生的主要反应的离子方程式为 。
(2)从图中推断NaH2PO4溶液中各种微粒浓度大小关系正确的是 。(填选项字母)
a、 C(Na+)> C(H2PO4 -)> C(H+)> C(HPO4 2-)> C(H3PO4 )
b、 C(Na+)> C(H2PO4 -)> C(OH-)> C( H3PO4)> C(HPO4 2- )
c、 C(H+)+ C(Na+)=C(OH-)+C(H2PO4-)+2C(HPO42-)+3C(PO43-)+C(H3PO4 )
d、 C(Na+)=C(H2PO4-)+C(HPO42-)+C(PO43-)+C(H3PO4 )
(3)假设25℃条件下测得0.1 mol·L–1的Na3PO4溶液的pH=12 ,近似计算出Na3PO4的第一步水解的水解常数Kh (写出计算过程,忽略Na3PO4的第二、第三步水解,结果保留两位有效数字)。
III,化学在环境保护中起着十分重要的作用,电化学降解法可用于治理酸性水中的硝酸盐污染。电化学降解NO3-的原理如下图所示。
电源正极为 (填A或B),阴极反应式为 。
正确答案
见解析
解析
I:CH3OH(g)+3/2 O2(g)= CO2(g)+2H2O(l) △H=-725.8kJ/mol (2分)
II:(1)> HPO4 2- + H+ === H2PO4 - (每空2分,共4分)
(2)ad(2分)
(3)PO43- + H2O 
起始浓度(mol·L–1): 0.1 0 0
变化浓度(mol·L–1): 0.01 0.01 0.01
平衡浓度(mol·L–1): 0.09 0.01 0.01 (1分)
Kh === C (HPO4 2-)× C(OH-)/ C( PO43- )=== 0.01 × 0.01 / 0.09 === 1.1 × 10 -3 mol·L–1
(2分,共4分)
II: A
2NO3-+10e-+12H+=6H2O +N2↑ (每空2分,共4分)
知识点
扫码查看完整答案与解析