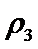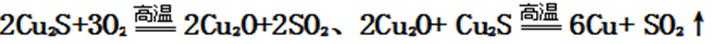- 质量数与质子数、中子数之间的相互关系
- 共19题
现有A、B、C、D、E五种原子序数依次增大的前四周期元素,A元素原子序数与周期序数相同;B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物;D是所在周期的原子序数最大的金属元素; E处于第四周期且其基态原子价层电子排布式为md2mnsn-2。请回答下列问题(用元素符号或化学式作答):
8.(1)BA3分子的空间构型为 ,B、C元素的第一电离能大小关系为 。
9.与D元素同族的短周期元素M与B元素形成的某种化合物是具有特殊功能的陶瓷,其晶胞结构如图,则每个晶胞中含M原子的个数为 ,该功能陶瓷的化学式为 。
10.A、C两元素形成原子个数比1∶1的化合物在酸性条件下能将E2+氧化,写出其离子方程式 。
11.写出以金属D、E为两电极、NaOH溶液为电解质溶液组成原电池的负极反应式 。
12.已知在微生物作用的条件下,BA4+经过两步反应被氧化成BC
正确答案
(1)三角锥形 ; N>O(或O
解析
由于A元素原子序数与周期序数相同可以判断其为H元素,“B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物”并结合化学元素周期表中前四周期非金属元素可知,B、C分别为:N和O;E位于第四周期,其核外电子层有4层,可知其基态原子价层电子排布md2mnsn-2中m为3,n为4,其电子排布为3d64s2,其原子序数为26,为Fe元素;D作为同周期原子序数最大的金属元素,其原子序数小于Fe,大于O;故只能是第三周期的Al元素
(1)BA3为NH3,其空间结构和N元素的特性有关,N存在孤对电子,NH3的空间结构为
三角锥形;N的电子排布为:1s22s22p3,第二层的第二亚层p中有三个电子,处于半充满状态,比较稳定,故相对于电子排布为1s22s22p4的O元素更加稳定,所以N的第一电离能大于O元素的第一电离能
考查方向
解题思路
利用化学元素周期表、原子核外电子排布规律和题干中给出的信息判断出各个元素,根据短周期元素的特性以及题目中给出的信息结合对氧化还原反应的理解,推断出相应的分子结构和相关的化学反应方程式;
易错点
对原子核外电子排布规律理解不清晰,对短周期元素的特性及其规律没有认识到位,无法推断出相应的元素,对价层电子互斥理论概念理解有误,晶胞的原子个数比例的计算有误
正确答案
(2)2 ; BN
解析
由于A元素原子序数与周期序数相同可以判断其为H元素,“B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物”并结合化学元素周期表中前四周期非金属元素可知,B、C分别为:N和O;E位于第四周期,其核外电子层有4层,可知其基态原子价层电子排布md2mnsn-2中m为3,n为4,其电子排布为3d64s2,其原子序数为26,为Fe元素;D作为同周期原子序数最大的金属元素,其原子序数小于Fe,大于O;故只能是第三周期的Al元素
(2)Al的同族短周期元素为B,由N的特性可知,其中的黑色原子应为N,晶包顶点处的B原子
同时属八个晶胞所共有,包括晶胞内部的一个B原子,故一个晶胞中应该有2个B原子,四周四个棱上的N原子同时属于四个晶包,加上内部一个N原子共有2个,所以陶瓷的化学式应该为BN
考查方向
解题思路
利用化学元素周期表、原子核外电子排布规律和题干中给出的信息判断出各个元素,根据短周期元素的特性以及题目中给出的信息结合对氧化还原反应的理解,推断出相应的分子结构和相关的化学反应方程式;
易错点
对原子核外电子排布规律理解不清晰,对短周期元素的特性及其规律没有认识到位,无法推断出相应的元素,对价层电子互斥理论概念理解有误,晶胞的原子个数比例的计算有误
正确答案
(3)2Fe2++H2O2+2H+=2Fe3++2H2O
解析
由于A元素原子序数与周期序数相同可以判断其为H元素,“B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物”并结合化学元素周期表中前四周期非金属元素可知,B、C分别为:N和O;E位于第四周期,其核外电子层有4层,可知其基态原子价层电子排布md2mnsn-2中m为3,n为4,其电子排布为3d64s2,其原子序数为26,为Fe元素;D作为同周期原子序数最大的金属元素,其原子序数小于Fe,大于O;故只能是第三周期的Al元素
(3)H和O两种元素1:1形成的化合物可以判断为H2O2,其与Fe2+在酸性溶液中反应的氧化还原
反应式应该为:H2O2+ 2Fe2++2H+=2H2O+2Fe2+;
考查方向
解题思路
利用化学元素周期表、原子核外电子排布规律和题干中给出的信息判断出各个元素,根据短周期元素的特性以及题目中给出的信息结合对氧化还原反应的理解,推断出相应的分子结构和相关的化学反应方程式;
易错点
对原子核外电子排布规律理解不清晰,对短周期元素的特性及其规律没有认识到位,无法推断出相应的元素,对价层电子互斥理论概念理解有误,晶胞的原子个数比例的计算有误
正确答案
(4)Al-3e-+4OH-=AlO2-+2H2O
解析
由于A元素原子序数与周期序数相同可以判断其为H元素,“B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物”并结合化学元素周期表中前四周期非金属元素可知,B、C分别为:N和O;E位于第四周期,其核外电子层有4层,可知其基态原子价层电子排布md2mnsn-2中m为3,n为4,其电子排布为3d64s2,其原子序数为26,为Fe元素;D作为同周期原子序数最大的金属元素,其原子序数小于Fe,大于O;故只能是第三周期的Al元素
(4)Al和Fe两种元素的化学活泼性:Al > Fe,故Al应该为负极,反应式为:Al-3e-+4OH-=2H2O+AlO2-;
考查方向
解题思路
利用化学元素周期表、原子核外电子排布规律和题干中给出的信息判断出各个元素,根据短周期元素的特性以及题目中给出的信息结合对氧化还原反应的理解,推断出相应的分子结构和相关的化学反应方程式;
易错点
对原子核外电子排布规律理解不清晰,对短周期元素的特性及其规律没有认识到位,无法推断出相应的元素,对价层电子互斥理论概念理解有误,晶胞的原子个数比例的计算有误
正确答案
(5)NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH=-346 kJ/mol
解析
由于A元素原子序数与周期序数相同可以判断其为H元素,“B、C同周期左右紧邻且二者能形成多种常见有害于大气的气态化合物”并结合化学元素周期表中前四周期非金属元素可知,B、C分别为:N和O;E位于第四周期,其核外电子层有4层,可知其基态原子价层电子排布md2mnsn-2中m为3,n为4,其电子排布为3d64s2,其原子序数为26,为Fe元素;D作为同周期原子序数最大的金属元素,其原子序数小于Fe,大于O;故只能是第三周期的Al元素
(5)由图知热化学方程式中第一步反应应为:2NH4+(aq)+3O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH=-273 KJ/mol;N的化合价从-3上升到了+3价,上升了6个价位;第二步反应: 2NO2-(aq)+O2(g)=2NO3-(aq) ΔH=-73 KJ/mol;N的化合价从+3价上升到+5价,上升了2个价位;故总反应方程式为:2NH4+(aq)+4O2(g)=2NO2-(aq)+2H2O(l)+4H+(aq) ΔH=-346 kJ/mol
考查方向
解题思路
利用化学元素周期表、原子核外电子排布规律和题干中给出的信息判断出各个元素,根据短周期元素的特性以及题目中给出的信息结合对氧化还原反应的理解,推断出相应的分子结构和相关的化学反应方程式;
易错点
对原子核外电子排布规律理解不清晰,对短周期元素的特性及其规律没有认识到位,无法推断出相应的元素,对价层电子互斥理论概念理解有误,晶胞的原子个数比例的计算有误
8.NA为阿伏加德罗常数的值,下列叙述正确的是
正确答案
解析
A.重水的摩尔质量为20g/mol,含10个电子,故20g重水的物质的量为1mol,故含10mol电子即10NA个,故A正确;
B.溶液体积不明确,故溶液中氢氧根的个数无法计算,故B错误;
C.钠反应后变为+1价,故1mol钠失去1mol电子即NA个,故C错误;
D.当反应生成2molHCl时,断裂2mol化学键,故当生成标况下22.4LHCl即1molHCl时,断裂1mol化学键即NA个,故D错误.
故选A.
考查方向
阿伏加德罗常数
解题思路
A.重水的摩尔质量为20g/mol,含10个电子;
B.溶液体积不明确;
C.钠反应后变为+1价;
D.当反应生成2molHCl时,断裂2mol化学键.
易错点
本题容易出现公式使用的不熟练和物质结构记忆错误。
知识点
【科目】化学
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如右下图所示。
20.基态Ti原子的价电子轨道表示式为 。
21.NaH的熔点为800℃,不溶于有机溶剂。NaH属于 晶体,其电子式为 。
22.AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为 (标明配位键)。
23.AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的两种离子 (填化学式)。
24.NaAlH4晶体中,与Na+紧邻且等距的AlH4-有 个;NaAlH4晶体的密度为 g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
25.NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
正确答案

解析
:Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,价电子排布式为3d24s2,价电子轨道表示式为

考查方向
解题思路
Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,价电子排布式为3d24s2,根据原子轨道中电子的填充规则画出其价电子轨道表示式;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
离子 Na+[∶H]-
解析
NaH的熔点为800℃,不溶于有机溶剂,属于离子晶体;NaH是离子化合物,电子式为Na+[:H]-;
故答案为:离子;Na+[:H]-;
考查方向
解题思路
离子晶体的熔沸点较高,一般不溶于有机溶剂;NaH是离子化合物,其电子式由阴、阳离子的电子式组合而成;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
解析
氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键,如图

考查方向
解题思路
AlCl3在178℃时升华,其蒸气的相对分子质量约为267,则分子式为Al2Cl6,氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
sp3 NH4+、BH4−(或“SO42−”“PO43−” 等其他合理答案)
解析
AlH4-中,Al的价层电子对数=4+1/2(3+1-1×4)=4,所以Al原子为sp3杂化;等电子体的结构相似,所以AlH4-空间构型相同的两种离子NH4+、BH4-(或“SO42-”“PO43-”);故答案为:sp3;NH4+、BH4-(或“SO42-”“PO43-”);
考查方向
解题思路
先求出中心原子的价层电子对数,再判断杂化类型;根据等电子体的结构相似;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
8 

解析
: 以底面Na+离子研究,与之最近的AlH4-距离为√2/2anm,位于同一面的4个顶角以及其余4个侧面的面心上,共有8个;根据均摊法可知,晶胞中钠离子的个数为6×0.5+4×1/4=4,晶体的化学式为NaAlH4,所以晶胞中AlH4-的个数为4,该晶胞的质量为54×4/NAg,该晶胞体积为2a3nm3=2a3×10-21cm3,则该晶胞的密度为(216/NA)2a3×1021g•cm-3=108×1021/2a3NAg•cm-3;晶胞中AlH4-的个数为4,钠离子的个数为4,若NaAlH4晶胞底心处的Na+被Li+取代,则晶胞中AlH4-的个数为4,钠离子的个数为3,锂离子的个数为1,晶体的化学式为:Na3Li(AlH4)4;故答案为:8;
考查方向
解题思路
以底面Na+离子研究,与之最近的AlH4-位于同一面的4个顶角以及其余4个侧面的面心上;根据晶胞类型以及化学式计算出晶胞所含原子数,根据公式ρ=
易错点
核外电子分布图的书写,离子构型的书写
正确答案
3NaAlH4 == Na3AlH6 + 2Al + 3H2↑
解析
NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,即产物有Al、H2和AlH63-,方程式为:3NaAlH4═Na3AlH6+2Al+3H2↑;
故答案为:3NaAlH4═Na3AlH6+2Al+3H2↑.
考查方向
解题思路
根据NaAlH4的释氢机理得出产物,从而写出方程式.
易错点
核外电子分布图的书写,离子构型的书写
二氧化氯是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂。回答下列问题:
18.二氧化氯可溶于水,但常温下难以与水反应,加热时会发生反应生成等物质的量的次氯酸和氯气,同时放出氧气,该反应的化学方程式为_____________________________,产物之一次氯酸的电子式为_____________。二氧化氯还能溶于强碱溶液,该过程中发生反应生成等物质的量的氯酸钠和另一种氯的含氧酸盐,同时生成水,该反应的离子方程式为________________________________。
19.工业上可利用电解法制备二氧化氯,如图为以石墨作电极制备二氧化氯的过程,写出产生二氧化氯气体的电极反应式:____________________。可利用滴定法测定电解过程中产生的二氧化氯,其过程如下:在锥形瓶中加入足量用硫酸酸化的碘化钾溶液,将生成的二氧化氯通入锥形瓶中至完全吸收,再向锥形瓶中滴加几滴淀粉溶液,用0.1 mo1·L1硫代硫酸钠标准液进行滴定(I2+2S2O32-==2I-+S4O62-),共用去100.00 mL标准液。则电解过程中产生的气体折算为标准状况下的体积为________mL
正确答案
12ClO2 + 2H2O 

解析
根据二氧化氯与水反应生成次氯酸和氯气,同时放出氧气,可以先写出相应的反应物和生产物,然后根据化合价升降总数相等完成配平的第一步骤:ClO2每生成1mol的HClO 和Cl2,化合价总共降低11,而每生成一个氧气,化合价升高4,所以最小公倍数为44,再用观察法配平H2O的系数为2,所以该反应的化学方程式为12ClO2 + 2H2O 



考查方向
解题思路
根据二氧化氯与水反应生成次氯酸和氯气,同时放出氧气,可以先写出相应的反应物和生产物,然后根据化合价升降总数相等完成配平,再用观察法配平H2O的系数为2。产物次氯酸中氧元素为中心原子,根据化合价升降守恒的原则,生成1mol氯酸钠,化合价升了1,所以也要降低1,故应该生成+3价的亚氯酸。
易错点
不能有效提取相关信息书写陌生的方程式,不能通过电子守恒法进行氧化还原滴定的计算,最后在计算电解过程中产生的气体折算为标准状况下的体积时容易忽略H2的体积。
正确答案
Cl- + 2H2O – 5e- = ClO2↑+ 4H+;156.8
解析
以石墨作电极制备二氧化氯的过程就是将Cl-氧化为ClO2的过程,所以电极反应式为:Cl- + 2H2O – 5e- = ClO2↑+ 4H+。ClO2 有较强氧化性,把I- 氧化为I2 ,根据反应过程中电子得失可以得出三者关系:2ClO2 ~5I2~10S2O32-n(ClO2)=0.2n(S2O32-)=0.2×0.01=0.002mol。根据电解过程中的电子守恒可以知道,再阳极每生成1molClO2,同时在阴极要生成2.5molH2。则电解过程中产生的气体折算为标准状况下的体积为(0.002+0.005)×22400=156.8 mL故答案为:Cl- + 2H2O – 5e- = ClO2↑+ 4H+;156.8。
考查方向
解题思路
以石墨作电极制备二氧化氯的过程就是将Cl-氧化为ClO2的过程;ClO2 有较强氧化性,把I- 氧化为I2 ,根据反应过程中电子得失可以得出三者关系:再根据电解过程中的电子守恒确定阴极产生的H2。电解过程中产生的气体折算为标准状况下的体积ClO2与H2的总和。
易错点
不能有效提取相关信息书写陌生的方程式,不能通过电子守恒法进行氧化还原滴定的计算,最后在计算电解过程中产生的气体折算为标准状况下的体积时容易忽略H2的体积。
氨是化肥工业和基本有机化工的主要原料,合成氨工业因此成为基本无机化工之一。回答下列问题:
23.如何获得廉价的氢气是合成氨工业中的重要课题,目前常用戊烷跟水蒸气反应的方法 获得氢气: C5H12(g)+5H2O(g) 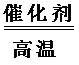
24.合成氨的反应原理为: 3H2(g)+N2(g) 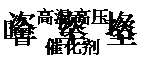
现有甲、乙、丙3个固定容积为2 L的密闭容器,在相同温度和催化剂条件下,按不同的反应物投入量进行合成氨反应,相关数据如下表所示: 
①下列描述不能说明该反应已达到平衡状态的是_______.(填序号);容器内混合气体的密度保持不变 b.3v正(N2)==v逆(H2)c.容器内混合气体的平均相对分子质量保持不变
②乙容器中的反应在20 min后达到平衡,这段时间内NH3的平均反应速率v(NH3)= _____mol·L-1·min-1,该温度下,反应的平衡常数K=_

25.在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要采取的措施是________。
正确答案
c-5a-11b
解析
根据能量变化图可以得出:
C5H12(g)+8O2(g) ==5CO2(g)+6H2O(g) △H= ckJ·mol-1
①H2O(g) ===1/2O2(g)+H2(g) △H= -bkJ·mol-1
②CO2(g) ===1/2O2(g)+CO(g) △H= -akJ·mol-1
③根据盖斯定律,①+②×11+③×5得出 C5H12(g)+5H2O(g) 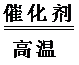
考查方向
解题思路
根据能量变化图可以得出:相关的热方程式,然后根据盖斯定律求解;
易错点
无
正确答案
①a ②0.05;5.33 ③ac
解析
①a 气体的体积不变,质量守恒,所以密度始终不变,不能根密度不再变化来判断平衡状态,故a错误; b.当3v正(N2)==v逆(H2)时,说明单位时间内消耗的N2与单位时间内生成的N2量相等,故达到了平衡状态,b正确;c.该反应是一个反应前后气体物质的量发生变化的化学反应,由于反应前后质量守恒,所以容器内混合气体的平均相对分子质量保持不变,就达到了平衡状态。故答案为a。
②乙容器中的反应在20 min后达到平衡时,消耗的N2为4-2×1.5=1mol,所以这段时间内N2的平均反应速率v(N2)= [1mol/(2L) ]/(20min)=1/40 mol·L-1·min-1,所以v(NH3)=2v(N2) =0.05_mol·L-1·min-1,平衡时c(N2)=1.5 mol·L-1 ,c(H2)=0.5 mol·L-1,c(NH3)=1 mol·L-1,所以该温度下,反应的平衡常数K=c2(NH3)/[c(N2) × c3(H2)]=5.33L2·mol-2,所以答案为:0.05;5.33
③a由等效平衡可知,若丙中2molNH3完全转化为N2和H2,则有1molN2和3molH2,由于甲中只有2molN2,所以反应达到平衡时消耗的N2更少,所以cl>c3,所以a正确;b.甲与乙为恒压条件下的等效平衡,此时两个容器中N2的体积分数相等,当在衡容条件下,相当于给容器乙加压,所以乙中平衡正向移动,故w2<w1 所以b错误; c.容器体积相同,乙中含有4molN2和4molH2,质量最大,丙中含有2molNH3,质量最小,密度大小关系为: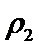
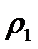
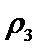
故答案:ac。
考查方向
解题思路
①a 气体的体积不变,质量守恒,所以密度始终不发生变化变;b.当3v正(N2)==v逆(H2)时,说明单位时间内消耗的N2与单位时间内生成的N2量相等;c.该反应是一个反应前后气体物质的量发生变化的化学反应,由于反应前后质量守恒,所以容器内混合气体的平均相对分子质量保持不变,就达到了平衡状态。
②根据乙容器中的反应在20 min后达到平衡时N2的浓度变化量求解出平均反应速率v(N2),再根据v(NH3)=2v(N2) 求解;根据平衡时c(N2)、c(H2)、c(NH3)求解该温度下反应的平衡常数K=c2(NH3)/[c(N2) × c3(H2)] ; ③a由等效平衡进行判断;b.甲与乙为恒压条件下的等效平衡,然后将容器乙加压,根据乙中平衡移动判断;c.容器体积相同,根据容器中气体质量判断密度大小。
易错点
(2)中等效平衡的实质理解不透导致解题错误。
正确答案
将产物混合气中的氨冷却分离后,剩余气体循环使用
解析
(3)在合成氨工业中,为了提高反应物的利用率,除了要提供适宜的温度、压强和使用催化剂外,还要可以通过将产物混合气中的氨冷却分离后以减小生成物的浓度,使得平衡正向移动,提高反应物的利用率,同时通过剩余气体循环使用提高反应物的利用率,故答案为将产物混合气中的氨冷却分离后,剩余气体循环使用。
考查方向
解题思路
为了提高反应物的利用率,除考虑温度、压强和使用催化剂外,还要可以通过将产物混合气中的氨冷却分离后以减小生成物的浓度,使得平衡正向移动,提高反应物的利用率,同时通过剩余气体循环使用提高反应物的利用率。
易错点
无
2.下列说法正确的是()
正确答案
解析
A.高锰酸钾具有强氧化性,研磨时用力过大,容易发生爆炸,所以研磨高锰酸钾时一定要控制好力度,故A错误;
B.润洗后,从滴定管的下口放出,不能从上口倒出,其他操作均合理,故B错误;
C.油脂难溶于水,在乙醇中的溶解度较大,油脂制肥皂实验中加一定量的乙醇是为了增加油脂的溶解,增大与碱的接触面积,加快反应速率,故C正确;
D.起始温度应为混合前酸、碱的温度,然后混合后测定最高温度,以此计算中和热,故D错误。
故选C。
考查方向
解题思路
A.高锰酸钾为强氧化剂,不能用力研磨,否则容易发生爆炸;
B.润洗后,从滴定管的下口放出;
C.油脂难溶于水,在乙醇中的溶解度较大;
D.起始温度应为混合前酸、碱的温度。
易错点
本题考查化学实验方案的评价,涉及油脂的性质及皂化反应、滴定实验及操作等,侧重分析与实验能力的综合考查,注意实验的评价性分析,题目难度中等。
知识点
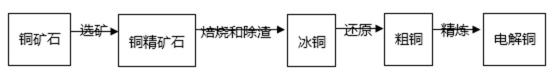
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。
22.该过程中两个主要反应的化学方程式分别是__________、__________;反射炉内生成炉渣的主要成分是__________。
23.冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜。该过程发生反应的化学
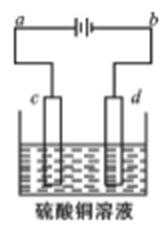
24.粗铜的电解精炼如右图所示。
①在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);
②在电极d上发生的电极反应式为____________;
③ 若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。
正确答案
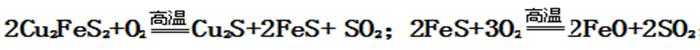
解析
①黄铜矿与空气反应生成Cu2S、FeS,根据化合价升降相等配平,反应方程式为:2CuFeS2+O2
-----Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2 ------2FeO+2SO2,故答案是:2CuFeS2+O2 -------Cu2S+2FeS+SO2;FeS+3O2---------2FeO+2SO2;②生成炉渣的主要成分为:FeSiO3,故答案为:FeSiO3;
考查方向
解题思路
黄铜矿与空气反应生成Cu和Fe的低价硫化物:产物为Cu2S、FeS;部分Fe的硫化物转变为Fe的低价氧化物:产物为FeO;反射炉内生成炉渣的主要成分是FeSiO3;
易错点
化合物的性质、电解精炼铜的工作原理
正确答案
解析
Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2 ---------2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S --------6Cu+SO2↑,
故答案是:2Cu2S+3O2 --------2Cu2O+2SO2;2Cu2O+Cu2S --------6Cu+SO2↑;
考查方向
解题思路
Cu2S被氧化为Cu2O:2Cu2S+3O2 ----2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S------6Cu+2SO2↑;
易错点
化合物的性质、电解精炼铜的工作原理
正确答案
①c ②Cu2++2e-=Cu③Au、Ag以单质形式沉积在阳极下方,Fe以Fe2+形式进入电解液中
解析
①c连电源正极,d连电源的负极;故c为阳极,d为阴极,故答案为:c;②粗铜板应放在阳极,即c;d阴极发生还原反应,方程式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;③Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中,
故答案是:Au、Ag以单质形式沉积在阳极下方,Fe以Fe2+形式进入电解液中.
考查方向
解题思路
粗铜应该放在阳极,c是阳极;d是阴极,发生还原反应 Cu2++2e-=Cu;粗铜中的Au、Ag、,它们在电解槽中的下方,以单质形式沉积在c(阳极)下方;Fe以Fe2+的形式进入电解液中.
易错点
化合物的性质、电解精炼铜的工作原理
27. 目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。
(1)向浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1〜10nm之间)。
①向浓CaCl2溶液中通人NH3和CO2气体制纳米级碳酸钙时,应先通入NH3,后通 入C02。制备纳米级碳酸钙的离子方程式为______________
②判断产品中是否含有纳米级碳酸钙的实验方法为_____________。
(2)—定条件下,C(s)和H2O(g)反应,能生成C02(g)和H2(g)。将C(s)和H20(g)分别 加入甲、乙两个密闭容器中,发生反应:C(s)+2H20(g)
①T10C时,该反应的平衡常数K=_______
②乙容器中,当反应进行到1.5min时,H20(g)的物质的量浓度_______ (填选项字母)。
A. =0.8 mol/L B. -1.4 mol/L
C. <1.4 mol/L D. >1.4 mol/L
③丙容器的容积为1L,





④丁容器的容积为1L,



A. 0.6 mol、1.0 mol、0.5 mol、1.0 mol
B. 0.6 mol、2.0 mol、0 mol、0 mol
C. 1.0 moK2.0 mol、1.0 mol、2.0 mol
D. 0.25 mol、0.5 mol、0.75 mol、1.5 mol
(3)



①甲醚燃料电池的负极反应式为________
②A口导出的物质为_____________________ (填化学式)。
③若燃料电池通入

正确答案
(1)
①Ca2++2NH3+CO2+H2O=CaCO3+2NH4+
②丁达尔效应
(2)
①12.8
②C
③a/b < 1/2
④AD
(3)
①CH3OCH3+3H2O-12e-=2CO2↑+12H+
②H2SO4
③26.88 L
解析
解析已在路上飞奔,马上就到!
知识点
碳酸镁晶体是一种新型吸波隐形材料中的增强剂。
实验一:合成碳酸镁晶体的步骤:①配制一定浓度的MgSO4溶液和N
称取3.000g MgSO4样品配制250mL溶液流程如下图所示:
回答下列问题:
33.写出实验仪器名称:A ;B 。配制溶液过程中定容后的“摇匀”的实验操作为 。
34.检验碳酸镁晶体是否洗干净的方法是 。
实验二:测定产品MgCO3·nH2O中的n值(仪器和药品如图所示):
35.实验二装置的连接顺序为 (按气流方向,用接口字母abcde表示),
其中Ⅱ装置的作用是 。
36.加热前先通入N2排尽装置Ⅰ中的空气,然后称取装置Ⅱ、Ⅲ的初始质量。进行加热时还需通入N2的作用是 。
37.若要准确测定n值,至少需要下列所给数据中的 (填选项字母),写出相应1种组合情景下,求算n值的数学表达式:n= 。A.装置Ⅰ反应前后质量差m1 B.装置Ⅱ反应前后质量差m2 C.装置Ⅲ反应前后质量差m3
正确答案
电子天平(1分) 、250mL容量瓶(1分)把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀。(1分)
解析
称取3.000g MgSO4样品,需要用到电子天平,故A为电子天平,配制250mL溶液需要250mL容量瓶,故B为250mL容量瓶,“摇匀”的实验操作为把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀
考查方向
溶液的配制
解题思路
称取3.000g MgSO4样品,需要用到电子天平,配制250mL溶液需要250mL容量瓶
易错点
摇匀的基本操作叙述
教师点评
本题考查溶液配制的仪器及其基本步骤,属于基础内容,题目难度不大
正确答案
取最后一次洗涤液少许于试管,加入稀盐酸酸化,再加入几滴氯化钡溶液,若不再产
生白色沉淀,则说明沉淀已洗干净(其他合理答案均可)
解析
检验碳酸镁晶体是否洗干净的方法是取最后一次洗涤液少许于试管,加入稀盐酸酸化,再加入几滴氯化钡溶液,若不再产生白色沉淀,则说明沉淀已洗干净
考查方向
沉淀的洗涤
解题思路
检验沉淀已经洗涤干净的方法是检验洗涤液中是否含有硫酸根离子来检验是否洗净
易错点
操作叙述的严密性
教师点评
本题主要考查沉淀的洗涤方法,属于基本实验操作,题目难度不大
正确答案
a→e、d→b (1分) 吸收 CO2以便测定样品中碳元素的含量 (1分)
解析
加热装置Ⅰ产生的气体二氧化碳和水蒸气依次通过浓硫酸和氢氧化钠溶液吸收,可以测定二氧化碳和水蒸气的量,故装置连接顺序为a→e、d→b,其中Ⅱ装置为碱性溶液吸收CO2以便测定样品中碳元素的含量,进而计算MgCO3•nH2O中的n值
考查方向
定量测定实验
解题思路
实验目的是测定产品MgCO3•nH2O中的n值,需要测量水和二氧化碳的量,将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体
易错点
装置中导管的连接长进短出
教师点评
本题主要考查定量测定实验来确定组成,涉及实验装置的连接,题目难度不大
正确答案
将分解生成的气体全部带入装置B或C中,使其完全吸收,并防止倒吸
解析
进行加热时还需通入N2的作用是将分解生成的气体全部带入装置Ⅱ或Ⅲ中,使其完全吸收,减少测定产生的误差,并防止倒吸
考查方向
定量测定实验
解题思路
为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸
易错点
易忽略了防倒吸的作用
教师点评
本题主要考查定量测定实验,为避免引起实验误差,需要通入N2,同时避免引起倒吸,题目难度中等
正确答案
AB (或AC或BC) (1分)
n=22(m1—m2)/9m2 [或n=22m3/9(m1—m3)或n=22m3/9m2] (2分)
解析
若B装置中无残留物,通过装置D吸收的质量为生成水的质量,装置C吸收的是分解生成的二氧化碳的质量,b.装置C反应前后质量差m2 ,装置D反应前后质量差m3,可以计算
考查方向
定量计算
解题思路
若B装置中无残留物,通过装置D吸收的质量为生成水的质量,装置C吸收的是分解生成的二氧化碳的质量,据此计算物质的量得到n值
易错点
Ⅱ、Ⅲ装置的作用
教师点评
本题主要考查定量计算,涉及实验原理,计算,题目难度中等
扫码查看完整答案与解析