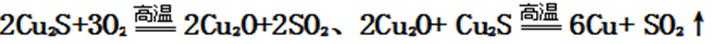- 质量数与质子数、中子数之间的相互关系
- 共19题
8.NA为阿伏加德罗常数的值,下列叙述正确的是
正确答案
解析
A.重水的摩尔质量为20g/mol,含10个电子,故20g重水的物质的量为1mol,故含10mol电子即10NA个,故A正确;
B.溶液体积不明确,故溶液中氢氧根的个数无法计算,故B错误;
C.钠反应后变为+1价,故1mol钠失去1mol电子即NA个,故C错误;
D.当反应生成2molHCl时,断裂2mol化学键,故当生成标况下22.4LHCl即1molHCl时,断裂1mol化学键即NA个,故D错误.
故选A.
考查方向
阿伏加德罗常数
解题思路
A.重水的摩尔质量为20g/mol,含10个电子;
B.溶液体积不明确;
C.钠反应后变为+1价;
D.当反应生成2molHCl时,断裂2mol化学键.
易错点
本题容易出现公式使用的不熟练和物质结构记忆错误。
知识点
【科目】化学
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢。NaAlH4可由AlCl3和NaH在适当条件下合成。NaAlH4的晶胞结构如右下图所示。
20.基态Ti原子的价电子轨道表示式为 。
21.NaH的熔点为800℃,不溶于有机溶剂。NaH属于 晶体,其电子式为 。
22.AlCl3在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为 (标明配位键)。
23.AlH4-中,Al的轨道杂化方式为 ;例举与AlH4-空间构型相同的两种离子 (填化学式)。
24.NaAlH4晶体中,与Na+紧邻且等距的AlH4-有 个;NaAlH4晶体的密度为 g·cm-3(用含a的代数式表示)。若NaAlH4晶胞底心处的Na+被Li+取代,得到的晶体为 (填化学式)。
25.NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,形成新的结构。这种结构变化由表面层扩展到整个晶体,从而释放出氢气。该释氢过程可用化学方程式表示为 。
正确答案

解析
:Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,价电子排布式为3d24s2,价电子轨道表示式为

考查方向
解题思路
Ti的原子序数为22,电子排布为1s22s22p63s23p63d24s2,价电子排布式为3d24s2,根据原子轨道中电子的填充规则画出其价电子轨道表示式;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
离子 Na+[∶H]-
解析
NaH的熔点为800℃,不溶于有机溶剂,属于离子晶体;NaH是离子化合物,电子式为Na+[:H]-;
故答案为:离子;Na+[:H]-;
考查方向
解题思路
离子晶体的熔沸点较高,一般不溶于有机溶剂;NaH是离子化合物,其电子式由阴、阳离子的电子式组合而成;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
解析
氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键,如图

考查方向
解题思路
AlCl3在178℃时升华,其蒸气的相对分子质量约为267,则分子式为Al2Cl6,氯化铝中铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
sp3 NH4+、BH4−(或“SO42−”“PO43−” 等其他合理答案)
解析
AlH4-中,Al的价层电子对数=4+1/2(3+1-1×4)=4,所以Al原子为sp3杂化;等电子体的结构相似,所以AlH4-空间构型相同的两种离子NH4+、BH4-(或“SO42-”“PO43-”);故答案为:sp3;NH4+、BH4-(或“SO42-”“PO43-”);
考查方向
解题思路
先求出中心原子的价层电子对数,再判断杂化类型;根据等电子体的结构相似;
易错点
核外电子分布图的书写,离子构型的书写
正确答案
8 

解析
: 以底面Na+离子研究,与之最近的AlH4-距离为√2/2anm,位于同一面的4个顶角以及其余4个侧面的面心上,共有8个;根据均摊法可知,晶胞中钠离子的个数为6×0.5+4×1/4=4,晶体的化学式为NaAlH4,所以晶胞中AlH4-的个数为4,该晶胞的质量为54×4/NAg,该晶胞体积为2a3nm3=2a3×10-21cm3,则该晶胞的密度为(216/NA)2a3×1021g•cm-3=108×1021/2a3NAg•cm-3;晶胞中AlH4-的个数为4,钠离子的个数为4,若NaAlH4晶胞底心处的Na+被Li+取代,则晶胞中AlH4-的个数为4,钠离子的个数为3,锂离子的个数为1,晶体的化学式为:Na3Li(AlH4)4;故答案为:8;
考查方向
解题思路
以底面Na+离子研究,与之最近的AlH4-位于同一面的4个顶角以及其余4个侧面的面心上;根据晶胞类型以及化学式计算出晶胞所含原子数,根据公式ρ=
易错点
核外电子分布图的书写,离子构型的书写
正确答案
3NaAlH4 == Na3AlH6 + 2Al + 3H2↑
解析
NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,即产物有Al、H2和AlH63-,方程式为:3NaAlH4═Na3AlH6+2Al+3H2↑;
故答案为:3NaAlH4═Na3AlH6+2Al+3H2↑.
考查方向
解题思路
根据NaAlH4的释氢机理得出产物,从而写出方程式.
易错点
核外电子分布图的书写,离子构型的书写
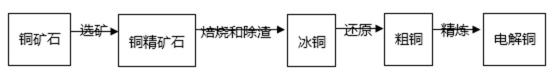
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流 程示意图如下:
在反射炉中,把铜精矿砂和石英砂混合加热到l000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。
22.该过程中两个主要反应的化学方程式分别是__________、__________;反射炉内生成炉渣的主要成分是__________。
23.冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O。生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜。该过程发生反应的化学
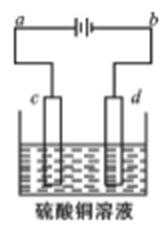
24.粗铜的电解精炼如右图所示。
①在粗铜的电解过程中,粗铜板应是图中电极_____(填图中的字母);
②在电极d上发生的电极反应式为____________;
③ 若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为______。
正确答案
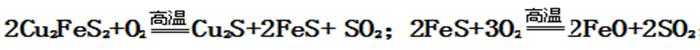
解析
①黄铜矿与空气反应生成Cu2S、FeS,根据化合价升降相等配平,反应方程式为:2CuFeS2+O2
-----Cu2S+2FeS+SO2;FeS和氧气反应生成FeO,根据化合价升降相等,配平方程式为:FeS+3O2 ------2FeO+2SO2,故答案是:2CuFeS2+O2 -------Cu2S+2FeS+SO2;FeS+3O2---------2FeO+2SO2;②生成炉渣的主要成分为:FeSiO3,故答案为:FeSiO3;
考查方向
解题思路
黄铜矿与空气反应生成Cu和Fe的低价硫化物:产物为Cu2S、FeS;部分Fe的硫化物转变为Fe的低价氧化物:产物为FeO;反射炉内生成炉渣的主要成分是FeSiO3;
易错点
化合物的性质、电解精炼铜的工作原理
正确答案
解析
Cu2S被氧化为Cu2O的反应方程式为:2Cu2S+3O2 ---------2Cu2O+2SO2;Cu2O与Cu2S发生反应的方程式为:2Cu2O+Cu2S --------6Cu+SO2↑,
故答案是:2Cu2S+3O2 --------2Cu2O+2SO2;2Cu2O+Cu2S --------6Cu+SO2↑;
考查方向
解题思路
Cu2S被氧化为Cu2O:2Cu2S+3O2 ----2Cu2O+2SO2;Cu2O与Cu2S反应:2Cu2O+Cu2S------6Cu+2SO2↑;
易错点
化合物的性质、电解精炼铜的工作原理
正确答案
①c ②Cu2++2e-=Cu③Au、Ag以单质形式沉积在阳极下方,Fe以Fe2+形式进入电解液中
解析
①c连电源正极,d连电源的负极;故c为阳极,d为阴极,故答案为:c;②粗铜板应放在阳极,即c;d阴极发生还原反应,方程式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;③Au、Ag比较稳定,不反应,以单质形式沉积在c(阳极)下方,Fe失去电子变成Fe2+的形式进入电解液中,
故答案是:Au、Ag以单质形式沉积在阳极下方,Fe以Fe2+形式进入电解液中.
考查方向
解题思路
粗铜应该放在阳极,c是阳极;d是阴极,发生还原反应 Cu2++2e-=Cu;粗铜中的Au、Ag、,它们在电解槽中的下方,以单质形式沉积在c(阳极)下方;Fe以Fe2+的形式进入电解液中.
易错点
化合物的性质、电解精炼铜的工作原理
碳酸镁晶体是一种新型吸波隐形材料中的增强剂。
实验一:合成碳酸镁晶体的步骤:①配制一定浓度的MgSO4溶液和N
称取3.000g MgSO4样品配制250mL溶液流程如下图所示:
回答下列问题:
33.写出实验仪器名称:A ;B 。配制溶液过程中定容后的“摇匀”的实验操作为 。
34.检验碳酸镁晶体是否洗干净的方法是 。
实验二:测定产品MgCO3·nH2O中的n值(仪器和药品如图所示):
35.实验二装置的连接顺序为 (按气流方向,用接口字母abcde表示),
其中Ⅱ装置的作用是 。
36.加热前先通入N2排尽装置Ⅰ中的空气,然后称取装置Ⅱ、Ⅲ的初始质量。进行加热时还需通入N2的作用是 。
37.若要准确测定n值,至少需要下列所给数据中的 (填选项字母),写出相应1种组合情景下,求算n值的数学表达式:n= 。A.装置Ⅰ反应前后质量差m1 B.装置Ⅱ反应前后质量差m2 C.装置Ⅲ反应前后质量差m3
正确答案
电子天平(1分) 、250mL容量瓶(1分)把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀。(1分)
解析
称取3.000g MgSO4样品,需要用到电子天平,故A为电子天平,配制250mL溶液需要250mL容量瓶,故B为250mL容量瓶,“摇匀”的实验操作为把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀
考查方向
溶液的配制
解题思路
称取3.000g MgSO4样品,需要用到电子天平,配制250mL溶液需要250mL容量瓶
易错点
摇匀的基本操作叙述
教师点评
本题考查溶液配制的仪器及其基本步骤,属于基础内容,题目难度不大
正确答案
取最后一次洗涤液少许于试管,加入稀盐酸酸化,再加入几滴氯化钡溶液,若不再产
生白色沉淀,则说明沉淀已洗干净(其他合理答案均可)
解析
检验碳酸镁晶体是否洗干净的方法是取最后一次洗涤液少许于试管,加入稀盐酸酸化,再加入几滴氯化钡溶液,若不再产生白色沉淀,则说明沉淀已洗干净
考查方向
沉淀的洗涤
解题思路
检验沉淀已经洗涤干净的方法是检验洗涤液中是否含有硫酸根离子来检验是否洗净
易错点
操作叙述的严密性
教师点评
本题主要考查沉淀的洗涤方法,属于基本实验操作,题目难度不大
正确答案
a→e、d→b (1分) 吸收 CO2以便测定样品中碳元素的含量 (1分)
解析
加热装置Ⅰ产生的气体二氧化碳和水蒸气依次通过浓硫酸和氢氧化钠溶液吸收,可以测定二氧化碳和水蒸气的量,故装置连接顺序为a→e、d→b,其中Ⅱ装置为碱性溶液吸收CO2以便测定样品中碳元素的含量,进而计算MgCO3•nH2O中的n值
考查方向
定量测定实验
解题思路
实验目的是测定产品MgCO3•nH2O中的n值,需要测量水和二氧化碳的量,将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体
易错点
装置中导管的连接长进短出
教师点评
本题主要考查定量测定实验来确定组成,涉及实验装置的连接,题目难度不大
正确答案
将分解生成的气体全部带入装置B或C中,使其完全吸收,并防止倒吸
解析
进行加热时还需通入N2的作用是将分解生成的气体全部带入装置Ⅱ或Ⅲ中,使其完全吸收,减少测定产生的误差,并防止倒吸
考查方向
定量测定实验
解题思路
为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸
易错点
易忽略了防倒吸的作用
教师点评
本题主要考查定量测定实验,为避免引起实验误差,需要通入N2,同时避免引起倒吸,题目难度中等
正确答案
AB (或AC或BC) (1分)
n=22(m1—m2)/9m2 [或n=22m3/9(m1—m3)或n=22m3/9m2] (2分)
解析
若B装置中无残留物,通过装置D吸收的质量为生成水的质量,装置C吸收的是分解生成的二氧化碳的质量,b.装置C反应前后质量差m2 ,装置D反应前后质量差m3,可以计算
考查方向
定量计算
解题思路
若B装置中无残留物,通过装置D吸收的质量为生成水的质量,装置C吸收的是分解生成的二氧化碳的质量,据此计算物质的量得到n值
易错点
Ⅱ、Ⅲ装置的作用
教师点评
本题主要考查定量计算,涉及实验原理,计算,题目难度中等
扫码查看完整答案与解析