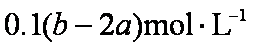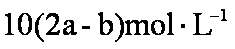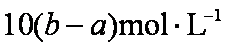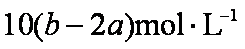- 化学综合计算
- 共266题
钠是活泼的碱金属元素,钠及其化合物在生产和生活中有广泛的应用。
完成下列计算:
(1)叠氮化钠(NaN3)受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32 L(标准状况下)氮气,至少需要叠氮化钠___g。
(2)钠-钾合金可在核反应堆中用作热交换液。5.05 g钠-钾合金溶于200 mL水生成0.075 mol氢气。
(i)计算溶液中氢氧根离子的物质的量浓度(忽略溶液体积变化)。
(ii)计算并确定该钠-钾合金的化学式。
(3)氢氧化钠溶液处理铝土矿并过滤,得到含铝酸钠的溶液。向该溶液中通入二氧化碳,有下列反应:
2NaAl(OH)4+CO2→2Al(OH)3↓ +Na2CO3+H2O
己知通入二氧化碳336 L(标准状况下),生成24 mol Al(OH)3和15 mol Na2CO3,若通入溶液的二氧化碳为112L(标准状况下),计算生成的Al(OH)3和Na2CO3的物质的量之比。
(4)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失。
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠。通过计算,分析和比较上表3组数据,给出结论。
正确答案
见解析。
解析
(1) 78 ;
(2)
(i)c(OH-)=
(ii)设上述合金中含amolNa、bmolK, a+b=0.75×2 23a+39b=5.05
a=0.050mol b=0.10mol,该钠-钾合金化学式为NaK2
(3)溶液含NaOH,NaOH与CO2反应生成的Na2CO3:15-
112LCO2的物质的量:112/22.4=5(mol) n[Al(OH)3]:n(Na2CO3)=[(5-3)×2]:5=4:5。
(4)由NaCl质量推算,氢氧化钠样品摩尔质量为:
M1(NaOH)=
M2(NaOH)=
M2(NaOH)=
结论:实验①所取氢氧化钠样品是NaOH;实验②和③所取氢氧化钠样品应该是NaOH·H2O。
本题以元素化合物为载体命题,意在考查考生的计算能力和分析、推理能力。
(1)利用“N”守恒可知需m(NaN3)=(40.32L/22.4L·mol-1)×2/3×65g·mol-1=78g。
(2)①由反应方程式可知产生1molH2同时生成2molOH-,故c(OH-)=(0.075mol×2)/0.2L=0.75mol/L;②设合金中Na、K的物质的量分别为amol、bmol,然后利用质量守恒与得失电子守恒可得方程式:a+b=0.75×2 和23a+39b=5.05,解之得a=0.050mol、b=0.10mol,故可得到合金的化学式为NaK2。
(3)若溶液中仅含NaAl(OH)4,利用方程式可知得到24molAl(OH)3的同时生成12molNa2CO3,而实际得到24molAl(OH)3与15molNa2CO3,说明溶液中含有NaOH,且NaOH优先与CO2反应生成Na2CO3,利用Na守恒知溶液中n(NaOH)=(15-12)mol×2=6mol,故通入112LCO2(5mol)先与NaOH作用消耗CO23mol生成3mol Na2CO3,然后2molCO2与NaAl(OH)4作用得到4molAl(OH)3和2mol Na2CO3,故生成n[Al(OH)3]:n(Na2CO3)=4:(3+2)=4:5。
(4)由NaOH+HCl=NaCl+H2O可知溶液PH=7时,二者恰好反应,故三次实验得到的固体均为纯净的氯化钠,故利用“钠守恒”得m(NaCl)/M(NaCl)=m(氢氧化钠样品)/M(氢氧化钠样品),利用该式和题中数据可计算出三次实验中所取氢氧化钠样品的摩尔质量,进而可得出结论。
知识点
标准状况下2.24LH2和Cl2组成的混合气体,经光照后缓缓通入100ml 1mol/LNaOH溶液中充分反应,测得最终溶液中NaClO的浓度为0.1mol/L(假设溶液体积不变,且不考虑水解),则原混合气体中Cl2的体积分数为 …
正确答案
解析
略
知识点
把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含 b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
正确答案
解析
a mol Na2SO4与BaCl2反应生成a mol BaSO4,则说明一份中含BaCl2 a mol ;b mol AgNO34与BaCl2和KCl反应会生成b mol AgCl,说明一份中总的Cl-为 b mol;而a mol BaCl2中含Cl-为2a mol,则一份中含KCl为(b-2a)mol,由于原溶液为5等份,应含KCl为5(b-2a)mol。故该混合溶液中钾离子浓度为5(b-2a) mol/0.5L=10(b-2a) mol/L。
知识点
你认为下列数据可信的是
正确答案
解析
略
知识点
标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为p g/ml,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
正确答案
解析
本题考查基本概念。考生只要对基本概念熟悉,严格按照基本概念来做,弄清质量分数与物质的量浓度及密度等之间的转化关系即可。
知识点
等浓度的下列稀溶液:①乙酸、②苯酚、③碳酸、④乙醇,它们的pH由小到大排列正确的是
正确答案
解析
依据酸性强弱的大小顺序:乙酸>碳酸>苯酚>乙醇,知D项正确。
知识点
把VL含有MgS04和K2S04的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
正确答案
解析
由离子反应方程式Mg2++2OH-=Mg(OH)2↓和Ba2++SO42-=BaSO4↓可知Mg2+和SO42-的物质的量分别为0.5amol和bmol,忽略溶液中的H+和OH-由电荷守恒知溶液中K+的物质的量为(b-0.5a)×2mol=(2b-a)mol。由于混合溶液分成两等份,所以选项C是错误的,正确的选项应该是D。
知识点




正确答案
解析
略
知识点
足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、N
正确答案
解析
略
知识点
1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的是
正确答案
解析
A. 设Cu Xg, Mg Yg,X+Y=1.52,X/64×98+Y/24×58=2.54,得X=0.02 Y=0.01
B. c(HNO3)=1000Ρɯ/M=1000×1.40×63/63=14.0mol/L
C. nHNO3=14.0×0.05=0.7mol=nNO2+2nN2O4,nNO2+N2O4=1.12L/22.4L/mol, nNO2=0.04 mol nN2O4=0.01 mol,可知C正确
D. 与硝酸反应的NaOH nNaOH=0.7-0.04-0.02=0.64,与金属离子反应的NaOH nNaOH=0.06,总NaOH的量 n总=0.64+0.06=0.7 mol,故需要NaOH 700 mL
知识点
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式。
该氢化物受撞击则完全分解为氮气和氢气。4.30g该氢化物受撞击后产生的气体在标准状况下的体积为_______L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0kg水,计算推进剂中联氨的质量。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为
6NO+ 4NH3=5N2+6H2O
6NO2+ 8NH3=7N2+12H2O
NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156mol氮气,吸收后氨水密度为0.980 g/cm3。
计算:①该混合气体中NO与NO2的体积比。②吸收后氨水的物质的量浓度(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比。
正确答案
(1)HN3 ;4.48
(2)64kg
(3)9:1;2.4molL
(4)3:1:1
解析
本题主要考察与化学有关的计算。
(1)一分子该氢化物中分子中含氮原子个数
(2)根据题意书写出方程式为2HN3=3H2+N2,则1mol该氢化物受撞击后产生的气体为2mol,4.30g氢化物的物质的量为0.1mol,产生0.2mol气体,标况下为4.48L。
(3)由联氨和四氧化二氮完全反应写出方程式为2N2H4 +N2O4=3N2+4H2O,生成72.0kg水需要联氨64kg。
①设NO与NO2的物质的量分别为x、y,则根据方程式:

联立方程组解得x=162mol y=18mol
根据阿伏伽德罗定律,二者体积比为162mol:18mol=9:1
②氨水中溶质的总物质的量为
根据反应方程式,消耗的氨气物质的量为
则吸收后的溶液中氨水的物质的量为157.058-132=25.058mol
吸收后的溶液中氨水的体积为
氨水物质的量浓度为25.058mol/10.43L=2.4molL
(4)由提示可得,生成链状二聚物、三聚物的方程式可简写为
2CO(NH2)2→二聚物+NH3 ……………………………①
3CO(NH2)2→三聚物+2NH3 ……………………………②
可以推出参加反应的尿素和生成氨气的物质的量之差为生成聚合物的物质的量
因此生成聚合物的物质的量=120mol-80mol=40mol
根据聚合物中碳原子守恒,可计算聚合物中平均含碳原子个数为120mol/40mol=3,而链状二聚物和三聚物的混合物中平均碳原子数只能小于3,说明除了生成链状二聚物、三聚物外还有环状三聚物,则 CO(NH2)2→环状三聚物+3NH3…………………………③
设生成二聚物、链状三聚物、环状三聚物的物质的量分别为x、y、z,则依据上述三个方程式,列方程组:

x + 2y +3z =80 mol
解得x=30mol y=10mol z=10mol
故三种聚合物的物质的量之比为30:10:10=3:1:1
另解:设最后产物中链状三聚物的物质的量分数为x,环状三聚物的物质的量分数为y,根据参加反应的尿素和生成的氨气比例列方程:

故三种聚合物的物质的量之比为0.6:0.2:0.2=3:1:1
知识点
用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/L的FeCl2溶液,研究废液再生机理。记录如下(a.b.c代表电压数值):
(1)用KSCN检验出Fe3+的现象是_______________________。
(2)I中,Fe3+产生的原因可能是Cl—在阳极放电,生成的Cl2将Fe2+氧化。写出有关反应:
____________________________________________________。
(3)由II推测,Fe3+产生的原因还可能是Fe2+在阳极放电,原因是Fe2+具有_________性。
(4)II中虽未检验出Cl2,但Cl—在阳极是否放电仍需进一步验证。电解pH=1的NaCl溶液做对照实验,记录如下:
①NaCl的浓度是_________mol/L
②IV中检测Cl2的实验方法______________________________________________。
③与II对比,得出的结论(写出两点):_____________________________________________。
正确答案
答案:(1)溶液变红
(2)2Cl— -2e— =Cl2↑ Cl2+2Fe2+=2Fe3++2Cl—
(3)还原
(4)①0.2 ②湿润的淀粉碘化钾试纸变蓝 ③加大电压cV以上时可以生成Cl2;阳极放电顺序Fe2+>Cl—
解析
略
知识点
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
正确答案
解析
由反应过程可知,碳酸钠溶液中滴入盐酸,先生成碳酸氢钠再转化为氯化钠和二氧化碳,根据题意两种方式均产生气体,且产生的二氧化碳体积不同,可判断出盐酸的量不足以把碳酸钠全部反应完全,故所加入盐酸的物质的量应大于碳酸钠物质的量,且小于碳酸钠物质的量的2倍,即0.20mol<n(HCl)<0.40mol,所以盐酸的浓度在1.0mol/L与2.0mol/L之间。
知识点
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体),下列分析或结果错误的是 ( )
正确答案
解析
略
知识点
粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。在实验室条件下以硫酸铜溶液为电解液,用电解的方法对粗铜提纯,并对阳极泥和电解液中金属进行回收和含量测定。回答以下问题:
步骤一:电解精制:粗铜应作电解池的________极(填“阴”或“阳”);
阴极的电极反应式为________;电解过程中,硫酸铜溶液的浓度会________(填“变大”、“不变”或“变小”)。
步骤二:电解完成后,对电解液进行处理:
(1)阳极泥的综合利用:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该步反应的离子方程式:___________。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到一些有关金的知
识,以下是他们获取的一些信息:
从中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比l :3的混合物),请你简要解释金能够溶于王水的原因:______________。
(2)滤液含量的测定:以下是该小组探究滤液的一个实验流程:
则100mL滤液中Cu2+的浓度为_______mol·L-1,Fe2+的浓度为_________mol·L-1。
正确答案
答案:
步骤一:阳 Cu2++2e = Cu 变小
步骤二:(1)3Ag + 4H+ + NO3— = 3Ag+ + NO↑+ 2H2O;
浓盐酸含有大量氯离子,Au3+ 离子与氯离子形成稳定的AuCl4—离子,使反应2平衡向右移动,则金溶于王水中。
(2)0.5 ;0.1
解析
略
知识点
扫码查看完整答案与解析