- 化学综合计算
- 共266题
interrupt
正确答案
5.下列关于合成材料的说法中,不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
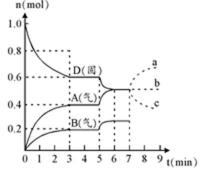
25.在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为____________mol/L·min。
(2)根据上图写出该反应的化学方程式________________________,该反应的平衡常数表达式为K =____________________。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应的正反应是_________(填“放热”或“吸热”)反应,反应的平衡常数_________(填“增大”、“减小”或“不变”。下同),B的反应速率_________。
(4)若在第7分钟时增加D的物质的量,A的物质的量变化正确的是______(用图中a、b、 c的编号回答)
正确答案
(1)0.067
(2)2D(s) 
(3)吸热 ;增大;增大
(4)b
解析
解析已在路上飞奔,马上就到!
知识点
17.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) = 2AlCl3 + 3H2。完成下列填空:
(1) A为浓硫酸,B为NaCl固体,写出烧瓶中发生反应的化学方程式:( )。
(2)进行实验时应先点燃 ( )(选填“B”或“D”)处酒精灯。
(3)用粗短导管连接D、E的目的是( )(选填序号)。
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
(4)F中盛有碱石灰,其目的是( )(选填序号)。
a. 吸收多余HCl b. 吸收Cl2 c. 吸收CO2 d. 防止空气中H2O进入E瓶
(5)将D中固体改为氯化铝晶体(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是( ) 。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 ( ) 。
正确答案
(1)
(2)B (1分)
(3)a(1分)
(4)ad(2分)
(5)抑制
解析
解析已在路上飞奔,马上就到!
知识点

(1)组装好仪器后必须进行的操作是( ),用2%的CuSO4溶液和10%的NaOH溶液配制Cu(OH)2悬浊液的注意事项是( )。
(2)为快速得到乙醇气体,可采取的方法是( )。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。取下小试管,加热,有砖红色沉淀生成,小试管中发生反应的化学方程式是( ) 。
(4)为了检验M的组成,进行下列实验。
① M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是( )
; 能得出的结论是( )(填写编号)。
a.M中一定有+3价和+2价铁,无0价铁 b.M中一定有+3价和0价铁,无+2价铁
c.M中一定有+3价,0价和+2价铁至少有一种 d.M中一定有+3价、+2价和0价铁
(5)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取m g M样品进行定量测定,实验装置和步骤如下:
① 组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是( )(填写编号)
a.①⑤④③②⑥⑦⑧ b.①⑤③④②⑥⑦⑧
c.①③⑤④②⑦⑥⑧ d.①③⑤②④⑥⑦⑧
(6)若实验中每步反应都进行完全,反应后M样品质量减少了n g,则FeXOY中
正确答案
解析
解析已在路上飞奔,马上就到!
知识点

(1)用2%的CuSO4溶液和10%的NaOH溶液配制Cu(OH)2悬浊液的注意事项是 ( )。
(2)为快速得到乙醇气体,可采取的方法是( )。若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是_________(填写编号);
a.取下小试管 b.移去酒精灯
c.将导管从乳胶管中取下 d.以上都可以
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。取下小试管,加热,有砖红色沉淀生成,小试管中发生反应的化学方程式是 ( )。
(4)为了检验M的组成,进行下列实验。
① M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
② 经检验溶液中有铁离子和亚铁离子,检验铁离子的方法是 ( ) ; 能得出的结论是( ) (填写编号)。
a.M中一定有+3价和+2价铁,无0价铁
b.M中一定有+3价和0价铁,无+2价铁
c.M中一定有+3价,0价和+2价铁至少有一种
d.M中一定有+3价、+2价和0价铁
(5)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取m g M样品进行定量测定,实验装置和步骤如下:
① 组装仪器;②点燃酒精灯;③加入试剂; ④打开分液漏斗活塞;⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。正确的操作顺序是 ( ) (填写编号)
a.①⑤④③②⑥⑦⑧ b.①⑤③④②⑥⑦⑧
c.①③⑤④②⑦⑥⑧ d.①③⑤②④⑥⑦⑧
(6)若实验中每步反应都进行完全,反应后M样品质量减少了n g,则FeXOY中
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13.8.34g FeSO4·7H2O样品在隔绝空气条件下受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。下列说法中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点

I.铁矿石中含氧量的测定步骤
①按上图组装仪器,检查装置的气密性。
②将10.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略)。
③从左端导气管口处不断地缓缓通入H2。
④ ( )。
⑤点燃A处酒精灯,充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)步骤④的操作是 ( ) 。
(2)装置C的作用为 ( ) 。
(3)测的反应后装置B增重2.7g,则铁矿石中氧的质量分数为 ( ) 。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 ( ) 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、( ) 。
(3)下列有关步骤⑥的操作中说法正确的是 ( ) 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.锥形瓶不需要用待测液润洗
d.滴定过程中,眼睛注视滴定管中液面变化
e.滴定结束后,30s内溶液不恢复原来的颜色再读数
(4)若滴定过程中消耗0.5000mol·L−1KI溶液20.00mL,则铁矿石中铁的质量分数为( )。
III.由I、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28.碱式碳酸盐A可用作胃药,其组成可表示为Al2Mg6(0H)x(C03)y.zH20。某校化 学兴趣小组欲测定其化学式,实验设计如下:
实验I:称取一定质量的A,加热分解至恒重。
实验II:称取一定质量的A,与足量的酸反应,测量生成CO2气体的质量。
可供选择的仪器和药品如图所示:(酸溶液限选6mol.L_1 HCl或6mol.L_1 H2SO4,其它 试剂任选。)
回答下列问题:
(1)仪器乙的名称为________。
(2)请选择必要的装置完成实验II,正确的连接顺序为________ (按气流方向,用接口字母表示);选用的酸溶液是________。
(3)有人提出不采用实验I,可在实验II结束后,在A完全反应后所得溶液中滴加足 量的氨水,用无灰滤纸过滤,用蒸馏水洗涤反应容器2〜3次,将洗涤液过滤,洗涤 沉淀2〜3次,将附着沉淀的滤纸放到坩埚中加热分解至恒重。判断沉淀已洗涤干净的方法是_________________,实际上未采用该方案的原因是不符合实验设计的________原则(填字母编号)。
A. 科学性
B.安全性
C.可行性
D.简约性
(4)x与y的关系式是________(用等式表示)。
(5)通过实验I的相关数据,经计算可得A的摩尔质量为602.0g.mol-1。实验II中称得 样品A的质量为9.030g,与足量酸完全反应后,CO2吸收装置增重0.660g,则A 的化学式为________
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.(13分)铁的化合物在化学研究中受到广泛重视,请回答下列问题:
(1)一种光敏材料的化学式是KxFe(C2O4)y· 3H2O ( Fe 为 +3 价),为测定其组成,称取一定质量的晶体置于烧杯中,加入足量的蒸馏水和稀 H2SO 4 ,将 C2O42-转化为 H2C2O4后用 0 .1020 mol/L的KMnO4溶液滴定,当消耗 KMnO4溶液 24.48mL 时恰好完全反应;再向溶液中加入适量的还原剂,恰好将 Fe3+完全转化为 Fe2+,用相同浓度的 KMnO4溶液继续滴定,当 Fe2+完全被氧化时,用去 KMnO4溶液 4.08mL 。通过计算确定该材料的组成( ) 。(写出简要计算过程)。
(2)在Fe2+、Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知含SO2的废气通入Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 ( ) 。
(3)纳米级Fe3O4是磁流体中的重要粒子,其制备原理可简单表示如下:
① 将化合物NH3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中生成两种碱,写出该反应过程的离子方程式( )。
② 上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为 ( )。
(4)复合氧化物铁酸锰(MnFe2O4)可以用于热化学循环分解水制氢,利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4 

若MnFe2O4-x中x=0.6,则MnFe2O4-x中Fe2+占全部铁元素的百分率为_______。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.设NA为阿伏加德罗常数的值。下列有关叙述中正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.利用“化学蒸气转移法”制备TaS2晶体,发生如下反应
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.I.氨是氮循环中的重要物质,在生产、生活和科研中有着广泛的应用。
一定条件下,将2molNH3和1molCO2充入容积为2L的密闭容器中发生反应2NH3(g)+CO2

II.在一固定体积的密闭容器中,在850℃时发生如下反应:
容器内各物质的浓度(mol/L)变化如下(在850℃时其化学平衡常数K=1.0)。
(1)下列可以作为判断该反应已经达到化学平衡状态依据的是_________________。
A.容器内压强不变
B.CO的消耗速率等于CO2的生成速率
C.混合气体中CO的体积分数不变
D.c(CO2):c(H2)=1:l
(2)上表中:cl=_____________mol/L。
III.若在25℃时,pH=a的氢氧化钠溶液与pH=b的醋酸溶液等体积混合,恰好完全反应。
(1)混合液中A-水解常数的表达式为Kh=__________________________。
(2)计算该温度下醋酸的电离常数(用含a、b的式子表示)为________________。
正确答案
II.C 0.08
III.
解析
解析已在路上飞奔,马上就到!
知识点
10.铁氧体(Fe3O4)法是处理含铬废水的常用方法,其原理是:用FeSO4把废水中Cr2O还原为Cr3+,并通过调节废水的pH,使生成物组成符合类似于铁氧体(Fe3O4或Fe2O3·FeO)的复合氧化物(x2-xO3·O)。处理含1 mol Cr2O废水至少需要加入a mol FeSO4·7H2O。下列结论正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
10.关于沉淀溶解平衡和溶度积常数,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析