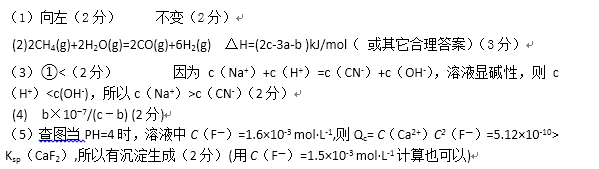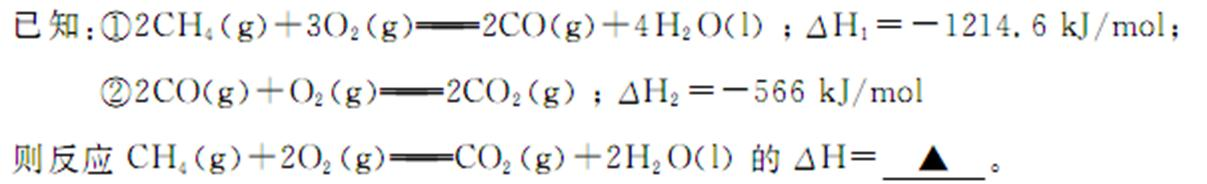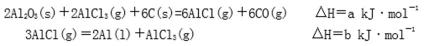- 化学综合计算
- 共266题
11.现在科学家正在寻求将太阳能转化成化学能,其中办法之一就是利用太阳能将H2O分解成H2,再将化学能转化为其它能源。下面是有关的能量循环示意图,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.新的《环境空气质最标准》(GB3095-2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1)汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因____。
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物转化为无毒的大气循环物质。已知:
则反应
该反应的△S_____________0(填“>”、“<”或“=”)。
(3)将0.20molNO和0.10 molCO充入一个容积恒定为1L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图所示。
①计算产物N2在6~9min时甲均反应速率v(N2)= ______mol·L-1·min-1;
②第12min时改变的反应条件为 ________(填“升温”、“降温”)
③计算反应在第24min时的平衡常数K=_________。若保持温度不变,再向容器中充入CO、N2各0.060mol,平衡将____移动(填“正向”、“逆向”或“不”)。
(4)环境监测中还可用沉淀法测定空气中含有较高浓度SO2的含量,经查得一些物质在20℃的数据如下表:
④吸收SO2最合适的试剂是___________[填“Ca(OH)2”或“Ba(OH)2”]溶液:
②在20℃时,向CaSO3悬浊液中滴加适最的BaCl7溶液,当CaSO3向BaSO3的转化达到平衡时,溶液中的
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.用CH4催化还原NO,可以消除氮氧化物的污染。例如:

正确答案
解析
解析已在路上飞奔,马上就到!
知识点
23. 请按要求完成下列各小题:
(1)合成氨反应N2 (g)+3H2(g)
气,则平衡( )(填“向左”“向右”或“不”) 移动;使用催化剂,上述反应的△H_______(填“增大” “减小” 或“不变”)。
(2)已知甲烷在高温下与水蒸气反应生成CO和H2。现有部分物质燃烧的热化学方程式如下: 2H2(g)+ O2(g)= 2H2O(g) △H=a kJ/mol
2CO(g)+ O2(g)= 2CO2(g) △H=b kJ/mol
CH4(g)+ 2O2(g)=CO2(g) + 2H2O(g) △H=ckJ/mol
请写出甲烷和水蒸气在高温下反应的热化学方程式( )。
(3)含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液。向其中加入少量酸或碱时,溶液的酸碱性变化不大。现将0.04mol·L-1HA溶液和0.02mol·L-1NaOH溶液等体积混合,得到缓冲溶液。
若HA为HCN,该溶液显碱性,则溶液中
(4)在25℃时,将c mol · L-1的醋酸溶液与b mol · L-1NaOH溶液等体积混合后溶液刚好呈中性,用含b、c的代数式表示CH3COOH的电离常数Ka =____________________。
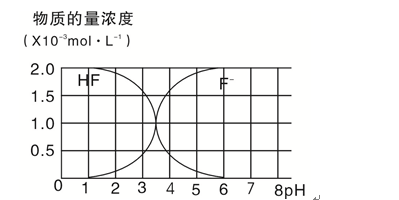
(5)25℃时,2.0×10-3 mol·L-1HF溶液中,调节溶液pH(忽略溶液体积变化)得到的(HF)、c(F—)与溶液pH的变化关系如图。若将4.0×10-4 mol·L-1CaCl2溶液与4.0×10-3 mol·L-1HF溶液等体积混合,调节混合液pH=4(忽略调节时混合液体积的变化),通过列式计算说明是否有CaF2沉淀析出。[已知Ksp(CaF2):1.5×10-10]( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.汽车安全气囊在初次发生猛烈碰撞后的几十毫秒内迅速打开,可有效缓冲驾驶员和前排乘客所遭受的冲击力度,保护其头部不受伤害。汽车安全气囊中含有MYn和红棕色金属氧化物、SiO2等物质。M、Y为短周期元素,其最外层电子数之和等于氧原子的最外层电子数,且可发生下图的转化关系。
(1)在2L密闭容器中投入2molY2和3.5molH2发生反应Ⅱ,测得YH3的物质的量在温度T1、 T2下随时间的变化如表所示:
① 已知该反应△H<0,则T1 T2 (填“>”、“<”或“=”);
②在温度T2下,达到平衡时YH3的平均速率v(YH3)= ( );平衡常数为( )(保留两位有效数字)。
③T2温度下达到平衡后,将容器的容积压缩到原来的1/2.在其他条件不变的情况下,对平衡体系产生的影响是 ( ) 。(填字母)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.YH3的物质的量增加 D.重新平衡时c(H2)/c(YH3)减小
(2) Y2H4是一种可燃性的液体,可用作火箭燃料。
①已知:N2(g)+2O2(g)==2NO2(g);△H= +67.7 kJ·mol-1
2N2H4(g)+2NO2(g) = 3N2(g) + 4H2O(g) △H=-1135.7 kJ·mol-1
计算反应:N2H4(g)+O2(g)==N2(g)+2H2O(g)△H=( ) kJ·mol-1
②水的电离方程式也可写为:H2O+H2O H3O++OH-,若液态Y2H4能够按照类似方式电离,请写出电离方程式:___________________________________。
③传统制备Y2H4的方法,是以MClO氧化YH3制得。反应Ⅲ的离子方程式是__________。
(3)Y2H4-空气燃料电池是一种高能电池,用20%-30%的KOH充当电解质溶液,则电池放电时的负极的电极反应式是 ( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.(Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。
其负极电极反应式是:叁一。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:

①实验1中,以v( H2)表示的平均反应速率为:( )。
②该反应的正反应为( )(填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是( )(用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2 SO4溶液。
①该电解槽中通过阴离子交换膜的离子数( )(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为( );
③电解一段时间后,B出口与C出口产生气体的质量比为( )。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
26.一氧化碳是一种用途相当广泛的化工基础原料。
(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍。
Ni(s)+4CO(g)
(2)在高温下一氧化碳可将二氧化硫还原为单质硫。已知:
(3)工业上一般采用CO与H2反应合成可再生能源甲醇,反应如下:
①某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应达到平衡后,测
得c(CO)=0.2mol·L-1,则CO的转化率为( )。
②合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,通过反应进行甲醇合成,T1℃下此反应的平衡常数为160。此温度下,在密闭容器中加入一定量CO和H2,反应到某时刻测得各组分的浓度如下:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.已知下列热化学方程式:
Zn(s)+
Hg(1)+
Zn(s)+HgO(s)==ZnO(s)+Hg(1)的焓变△H为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) 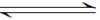
①0~10min内,NO的平均反应速率v(NO)=( ),T1℃时,该反应的平衡常数K=( );
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是( )(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q( )0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是( )(填选项编号)。
a.单位时间内生成2n mol NO(g)的同时消耗n mol CO2(g)
b.反应体系的温度不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(3)铝电池性能优越,Al—Ag2O电池可用作水下动力电源,其原理如下图所示:
请写出该电池正极反应式 ( );常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mg Al,则电解后溶液的pH=( )(不考虑溶液体积的变化)。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
13. 取少量0.1mol/
kJ·mol-1, 则Na2SO4(aq)+Ba(NO3)2(aq)=BaSO4(s)+2NaNO3(aq)∆H=( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx ,反应如下:
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42- 而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为( );
(4)肼(N2H4)用亚硝酸氧化可生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977。写出肼与亚硝酸反应的化学方程式( );
(5)N2O5是重要的硝化剂和氧化剂,可用电解法制备N2O5,如图乙所示,N2O5在电解池的 ( )(填“阳极”或“阴极”)区生成,其电极反应式为( ) 。
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.新的《环境空气质量标准》(GB3095-2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了 S02、NO2, CO、O3,PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
(1) 汽车排出的尾气中含有CO和NO等气体,用化学方程式解释产生NO的原因______。

已知:
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
11.现在科学家正在寻求将太阳能转化成化学能,其中办法之一就是利用太阳能将H2O分解成H2,再将化学能转化为其它能源。下面是有关的能量循环示意图,下列有关说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析