- 同一周期内元素性质的递变规律与原子结构的关系
- 共21题
利用化石燃料开采、加工过程产生的H2S废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为
②常温下,不能与M单质发生反应的是 (填序号)
a.CuSO4溶液
b.Fe2O3
c.浓硫酸
d.NaOH溶液
e.Na2CO3固体
(2)利用H2S废气制取氢气来的方法有多种
①高温热分解法
已知:
在恒温密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见右图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。据图计算985℃时H2S按上述反应分解的平衡常数K= ;说明随温度的升高,曲线b向曲线a逼近的原因:
②电化学法
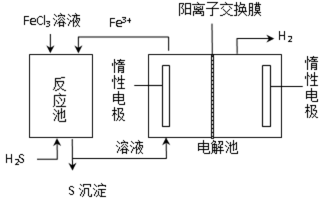
该法制氢过程的示意图如图。反应池中反应物的流向采用气、液逆流方式,其目的是 ;反应池中发生反应的化学方程式为 。反应后的溶液进入电解池,电解总反应的离子方程式为 。
正确答案
见解析。
解析
(1)①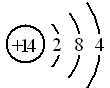
(2)①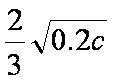
②增大反应物接触面积,使反应更反分
H2S + 2FeCl3 = 2FeCl2 + S↓ + 2HCl
知识点
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是 。
a,原子序数和离子半径均减小 b,金属性减弱,非金属性增强
c,氧化物对应的水合物碱性减弱,酸性增强 d,单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为 ,氧化性最弱的简单阳离子是 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是 ;制铝时,电解Al2O3而不电解AlCl3的原因是 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式: 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是 。
a, NH3 b, HI c, SO2 d ,CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式: 。
正确答案
(1)b
(2)氩 
(3)

(4)


(5)b
(6)
解析
略
知识点
已知33As、35Br位于同一周期,下列关系正确的是 ( )
正确答案
解析
略
知识点
氯和硫都是重要的非金属元素。下列叙述不能说明氯的非金属性比硫强的是
正确答案
解析
略
知识点
下列说法正确的是
正确答案
解析
略
知识点
扫码查看完整答案与解析