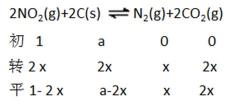- 常见无机物及其应用
- 共1311题
铜陵有色金属集团公司是电解铜产量全国第一的大型企业。其冶炼工艺中铜、硫回收率达到97%、87%。下图表示其冶炼加工的流程:
冶炼中的主要反应为:
15.碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:
① 用离子方程式表示反应器中发生的反应 。
② 用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是 。
③ 用吸收H2后的稀土储氢合金作为电池负极材料(用MH)表示),NiO(OH)作为电池正极材料,KOH溶液作为电解质溶液,可制得高容量、长寿命的镍氢电池。电池充放电时的总反应为:Ni(OH)2+M =NiO(OH)+MH,电池放电时,负极电极反应式为 ; 充电完成时,全部转化为NiO(OH),若继续充电,将在一个电极产生O2,O2扩散到另一个电极发生电极反应被消耗,从而避免产生的气体引起电池爆炸,此时,阴极电极反应式为 。
16.在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
①调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度Fe2+、Zn2+、Fe3+、Cu2+的溶液,随pH升高最先沉淀下来的离子是_________________。
②一种方案是先加入过量的H2O2,再调节pH到4左右,加入H2O2的目的是_______________。加入H2O2后发生反应的离子方程式为___________________。
正确答案
①SO2+I2+2H2O=SO42-+2I-+4H+
②HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行
③MH+OH--e-=H2O+M O2+4e-+2H2O=4OH-
解析
①碘循环工艺根据进出物质可得在反应器中发生反应:SO2+I2+2H2O ===2HI+H2SO4 ,故答案为:SO2+I2+2H2O=SO42-+2I-+4H+
②根据勒夏特列原理分析化学平衡移动;故答案为:HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行。
③负极反应物MH失去电子,生成的H+在碱性条件下生成H2O,电解反应式为:MH-e-+OH-=H2O+M;阴极上是氧气发生的电子的过程,电极反应式为:O2+2H2O+4e-=4OH-,故答案为:MH-e-+OH-=H2O+M ;O2+2H2O+4e-=4OH
考查方向
本题主要考查了工业电解冶炼金属铜原理、物质的分离和提纯、沉淀的溶解平衡应用、离子方程的书写,题目难度中等,注意掌握电解原理、物质的分离和提纯方法,试题培养了学生的分析、理解能力和实验设计能力。
解题思路
①碘循环工艺根据进出物质可得在反应器中发生反应:SO2+I2+2H2O ===2HI+H2SO4 ,
②根据勒夏特列原理分析化学平衡移动;
③根据负极反应的特点和总电池反应和氧气进入另一个电极后所引发的反应来解决电极反应式的问题。
易错点
氧化还原反应离子方程的书写、电极反应式的书写、勒夏特列原理的应用。
正确答案
①Fe3+
②将Fe2+氧化为Fe3+
2Fe2++2H++H2O2=2Fe2++2H2O
解析
①根据表中氢氧化物的溶度积可知,氢氧化铁的溶度积最小,其溶解度最小,所以随pH升高最先沉淀下来的离子是铁离子;故答案为:Fe3+;
②双氧水能够将溶液中的亚铁离子氧化成铁离子,反应的离子方程式为2Fe2++H2O2+2H+═2Fe3++2H2O,故答案为:将Fe2+氧化为Fe3+;
2Fe2++H2O2+2H+═2Fe3++2H2O
考查方向
本题主要考查了工业电解冶炼金属铜原理、物质的分离和提纯、沉淀的溶解平衡应用、离子方程的书写,题目难度中等,注意掌握电解原理、物质的分离和提纯方法,试题培养了学生的分析、理解能力和实验设计能力。
解题思路
根据溶度积与溶解度关系,溶度积越大溶解度越,随pH升高最先沉淀的是对应强氧化物的溶度积最小的离子分析。
易错点
氧化还原反应离子方程的书写、电极反应式的书写、勒夏特列原理的应用。
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要。
石墨烯是一种由碳原子构成的单层片状结构的新材料,结构如右图所示。
18.则12g石墨烯中含有 个6元环。
19.工业上利用甲烷和氧气直接氧化制取甲醇的反应如下:
20.苯乙烷(C8H10)生产苯乙烯(C8H8)的反应:C8H10(g) 

当反应进行到30 min时恰好到达平衡,则n2取值的最小范围是________;
改变温度为T2℃,其他条件不变,测得平衡时容器内气体压强为反应前的1.4倍,则此时苯乙烷的转化率为 。
21.用惰性电极电解葡萄糖和硫酸钠混合溶,可以制得葡萄糖酸[CH2OH(CHOH)4COOH]和己六醇[CH2OH(CHOH)4CH2OH]。葡萄糖酸在 极生成,对应的电极反应式 。
正确答案
0.5NA
解析
:一个碳原子参与三个碳的形成,所以形成一个六元环,需要碳原子的个数为:6×1/3=2,所以12g石墨烯物质的量为1mol,所以形成6元环的物质的量为:1/2mol,即0.5NA个6元环,故答案为:0.5NA;
考查方向
解题思路
】一个碳原子参与三个碳的形成,所以形成一个六元环,需要碳原子的个数为:6×1/3=2,由此分析解答;
易错点
外界条件对化学平衡的影响、盖斯定律、三行式的应用和电极反应式的书写
正确答案
解析
①CH4+0.5O2(g)⇌CH3OH(g)△H=-128.5kJ/mol,正反应是气体体积减少的反应,所以可以通增大压强、选用合适的催化剂,故答案为:增大压强、选用合适的催化剂;②由CH4+0.5O2(g)⇌CH3OH(g)△H=-128.5kJ/mol…Ⅰ,CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol…Ⅱ,目标反应CH3OH(g)+0.5O2(g)→HCHO(g)+H2O(g),得Ⅱ-Ⅰ得:CH3OH(g)+0.5O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1,故答案为:CH3OH(g)+0.5O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1;
考查方向
解题思路
】①可以从加快化学反应速率和平衡移动的角度分析解答;②根据盖斯定律分析求解;
易错点
外界条件对化学平衡的影响、盖斯定律、三行式的应用和电极反应式的书写
正确答案
0.22
解析
①平衡时的量比20min的量小,但变化量小于10min-20min,所以0.22<n<0.26,故答案为:0.22<n<0.26;②C8H10(g)⇌C8H8(g)+H2(g)
开始 0.40mol 0 0
变化 x x x
平衡0.40mol-x x x
所以:0.4+x/0.4=1.4,解之得:x=0.16,所以苯乙烷的转化率为0.16/0.4×100%=40%,故答案为:40%;
考查方向
解题思路
】①平衡时的量比20min的量小,但变化量小于10min-20min,所以0.22<n<0.26;②根据三行式求变化量;
易错点
外界条件对化学平衡的影响、盖斯定律、三行式的应用和电极反应式的书写
正确答案
阳 CH2OH(CHOH)4CHO+H2O-2e-== CH2OH(CHOH)4COOH+2H+(2分)
解析
葡萄糖到葡萄糖酸[CH2OH(CHOH)4COOH]发生氧化反应,所以在阳极产生,电极反应式为:CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+;故答案为:阳;CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
考查方向
解题思路
】葡萄糖到葡萄糖酸[CH2OH(CHOH)4COOH]发生氧化反应,所以在阳极产生,电极反应式为:CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
易错点
外界条件对化学平衡的影响、盖斯定律、三行式的应用和电极反应式的书写
京津冀环境污染控制国际论坛于2016年4月24日在天津工业大学隆重举行,倡导低碳社会也是一个重要的方面,研究CO2的利用对促进低碳社会的构建具有重要意义,二氧化碳合成甲醇是碳减排的新方向。
19.已知: ① 2H2(g) + O2(g) = 2H2O(g) △H=-484.0 kJ/mol
② CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= +49.0kJ/mol
③ H2O(g) = H2O(l) △H=-44.0 kJ/mol
请写出甲醇的燃烧热的热化学方程式, 该反应的平衡常数表达式为K= .
20.向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
①该反应自发进行的条件是 (填“低温”、“高温”或“任意温度”)
21.②下列叙述能说明此反应达到平衡状态的是 。
a、混合气体的平均式量保持不变
b、CO2和H2的转化率相等
c、CO2和H2的体积分数保持不变
d、混合气体的密度保持不变
e、1mol CO2生成的同时有1mol C-H键断裂
22.③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,t3时达到平衡,t4时降低温度,t5时达到平衡,请画出t2~t6 CO2的浓度随时间的变化。
23.改变条件,使反应CO2(g)+3H2(g) 
① 达到平衡时,该反应逆反应平衡常数K= 平衡时H2的 转化率是
24.②在其它条件不变下,若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,则T1 T2(填“>”、“<”或“=”)。若30min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡 移动(填“正向”、“逆向”或“不”)。
25.用硫酸溶液作电解质进行电解,CO2在电极上可转化为甲烷,该电极的反应式为________
正确答案
CH3OH (g)+ 3/2O2 (g) =CO2 (g)+2H2O (l) △H=-765kJ/mol K=
解析
① 2H2(g) + O2(g) = 2H2O(g) △H=-484.0 kJ/mol
② CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= +49.0kJ/mol
③ H2O(g) = H2O(l) △H=-44.0 kJ/mol
根据盖斯定律:②+3/2①+2③可得甲醇的燃烧热的热化学方程式,CH3OH (g)+ 3/2O2 (g) =CO2 (g)+2H2O (l)
△H=-765kJ/mol,该反应的平衡常数表达式为K=
考查方向
解题思路
根据盖斯定律:②+3/2①+2③可得甲醇的燃烧热的热化学方程式;
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
低温
解析
向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
①由② CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H= +49.0kJ/mol可知:CO2(g)+3H2(g) 
考查方向
解题思路
①△G=△H-T△S,该反应自发进行的条件是△G<0,低温有利于反应的自发进行;
后向正反应方向进行,逐渐减小;t3时达到平衡,因平衡常数不变,浓度恢复原来大小;t4时降低温度,反应向正方向进行,二氧化碳浓度减小;t5时达到平衡:
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
acd;
解析
向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
混合气体的平均式量保持不变,各种气体浓度不变,反应达到平衡状态,正确;
b、CO2和H2的转化率不变,则反应达到平衡状态,CO2和H2的转化率相等,反应未达到平衡状态,错误;
c、CO2和H2的体积分数保持不变,各种气体浓度不变,反应达到平衡状态,正确;
d、反应是体积减小的反应,混合气体的密度保持不变,各种气体浓度不变,反应达到平衡状态,正确;
e、1mol CO2生成的同时有1mol C-H键断裂,反应向逆反应方向进行,反应未达到平衡状态,错误;
故选acd;
考查方向
解题思路
根据化学平衡原理解释;
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
解析
向1L密闭容器中加入2mol CO2、6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g) 
CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,CO2的浓度瞬间增大一倍,然后向正反应方向进行,逐渐减小;t3时达到平衡,因平衡常数不变,浓度恢复原来大小;t4时降低温度,反应向正方向进行,二氧化碳浓度减小;t5时达到平衡,t2~t6 CO2的浓度随时间的变化如下图:
考查方向
解题思路
③ CO2的浓度随时间(0~t2)变化如下图所示,在t2时将容器容积缩小一倍,CO2的浓度瞬间增大一倍,然后向正反应方向进行,逐渐减小;t3时达到平衡,因平衡常数不变,浓度恢复原来大小;t4时降低温度,反应向正方向进行,二氧化碳浓度减小;t5时达到平衡:
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
① 0.15 50%
解析
改变条件,使反应CO2(g)+3H2(g) 
达到平衡时,该反应逆反应平衡常数
考查方向
解题思路
达到平衡时,该反应逆反应平衡常数
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
② < 不
解析
改变条件,使反应CO2(g)+3H2(g) 

考查方向
解题思路
反应向逆反应方向进行,一定是升高温度,则T1<T2。Qc=0.15=K,则平衡不移动;
易错点
本题考查了热化学方程式的书写、化学平衡移动、平衡常数概念理解、转化率的计算及原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
正确答案
CO2+8e﹣+8H+=CH4+2H2O。
解析
CO2在正极发生还原反应转化为甲烷,考虑电解质为硫酸,所以甲烷中氢来源为硫酸电离的氢离子,根据化合价变化可知1mol二氧化碳变成甲烷得到8mol电子,故电极反应为:CO2+8e﹣+8H+=CH4+2H2O。
考查方向
解题思路
CO2在正极发生还原反应转化为甲烷,考虑电解质为硫酸,所以甲烷中氢来源为硫酸电离的氢离子,根据化合价变化可知1mol二氧化碳变成甲烷得到8mol电子,故电极反应为:CO2+8e﹣+8H+=CH4+2H2O。
易错点
本题考查了原电池原理的分析应用等,题目涉及的知识点较多,综合性较强,难度中等.分析图象时,要考虑先拐先平衡的原则,则反应条件为温度高或压强大,写电极反应式一定要考虑介质的参与。
5. 常温下,下列说法正确的是( )
正确答案
解析
A.分别中和pH相同的等体积的盐酸和醋酸溶液,醋酸为弱酸,则醋酸的浓度大于盐酸,则醋酸消耗的NaOH较多,故A错误;
B.pH=a的CH3COOH溶液加水稀释10n倍后,稀释过程中醋酸的电离程度增大,则稀释10n倍后,溶液的pH变化小于n,即稀释后溶液的pH<a+n<7,故B错误;
C.pH相等的CH3COONa、NaOH溶液中,前者醋酸根离子水解促进了水的电离,而后者氢氧化钠电离出的氢氧根离子抑制了水的电离,所以水的电离程度不同,故C错误;
D.Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3),故D正确;
本题正确答案是D
考查方向
解题思路
A.醋酸为弱酸,pH相等时醋酸的浓度较大,消耗的氢氧化钠的物质的量较大;
B.醋酸在稀释过程中电离程度增大,则稀释10n倍后,溶液的pH变化小于n;
C.氢氧化钠抑制了水的电离,醋酸钠水解促进了水的电离;
D.根据碳酸钠溶液中的质子守恒判断
易错点
弱电解质的电离及影响、离子浓度大小比较、溶液pH的计算;
知识点
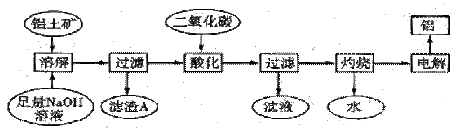
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质。工业上利用软锰矿制取碳酸锰(MnCO3)流程如下:
其中,还原焙烧主反应为:2MnO2+C=2MnO+CO2↑。根据要求回答问题:
14.步骤D中Fe2+被氧化,该反应的离子方程式为 。
15.步骤H的离子方程式为 。
16.加入Na2S可以除去Pb2+、Al3+等离子。已知Ksp(PbS)=1×10-28 Ksp(MnS)= 1×10-9.6 ,当溶液中c(Pb2+)=1×10-5mol·L-1时,溶液中c(Mn2+)允许的最大值为 。
17.pH=0的溶液中,不同价态锰的微粒的能量(△G)如右图。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒。
MnO42—能否稳定存在于pH=0的溶液中?
答:______________(“能”或“不能”);
将Mn3+歧化反应设计为原电池,可测定反应平衡常数。
电池负极反应为 ,平衡常数表达式为 ;
实验室可利用以下反应检验Mn2+存在:
2Mn2+ + 5S2O82- + 8H2O → 16H+ + 10SO42- + 2MnO4-
确认Mn2+存在的现象是 ;检验时必须控制Mn2+浓度和用量不能过大,否则实验失败。理由是 。
正确答案
2Fe2++MnO2+4H+==2Fe2++Mn2++2H2O
解析
步骤D中酸性溶液中Fe2+被MnO2氧化为铁离子,二氧化锰被还原生成锰离子,反应的离子方程式为:2Fe2++MnO2+4H+═2Fe2++Mn2++2H2O,故答案为:2Fe2++MnO2+4H+═2Fe2++Mn2++2H2O;
考查方向
解题思路
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑.加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化镍溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品,步骤D中酸性溶液中Fe2+被MnO2氧化为铁离子,二氧化锰被还原生成锰离子;
易错点
物质分离提纯和实验基本操作,离子性质、难溶物质溶度积常数的计算、氧化还原反应实质理解,注意图象的理解应用
正确答案
Mn2++2HCO3—= MnCO3↓+CO2↑+H2O
解析
步骤H是硫酸锰和碳酸氢铵反应,碳酸氢根离子过量,所以锰离子结合碳酸根离子生成碳酸锰沉淀,氢离子浓度增大和过量的碳酸氢根离子反应生成二氧化碳气体,反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
考查方向
解题思路
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑.加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化镍溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品,步骤H是硫酸锰和碳酸氢铵反应,碳酸氢根离子过量,所以锰离子结合碳酸根离子生成碳酸锰沉淀,氢离子浓度增大和过量的碳酸氢根离子反应生成二氧化碳气体;
易错点
物质分离提纯和实验基本操作,离子性质、难溶物质溶度积常数的计算、氧化还原反应实质理解,注意图象的理解应用
正确答案
1×1013.4 mol·L-1
解析
已知Ksp(PbS)=1×10-28,当溶液中c(Pb2+)=1×10-5mol•L-1时,c(S2-)=1×10−28/1×10−5
=10-23mol/L,Ksp(MnS)=1×10-9.6,溶液中c(Mn2+)允许的最大值=1×10−9.6/10−23=1×1013.4 mol•L-1,
故答案为:1×1013.4 mol•L-1;
考查方向
解题思路
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑.加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化镍溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品,当溶液中c(Pb2+)=1×10-5mol•L-1时沉淀完全,计算硫离子浓度,结合硫化锰溶度积计算锰离子的最大浓度;
易错点
物质分离提纯和实验基本操作,离子性质、难溶物质溶度积常数的计算、氧化还原反应实质理解,注意图象的理解应用
正确答案
①不能 ② Mn3++2H2O-e- =MnO2+4H+ K=c(Mn2+)·c4(H+)/c2(Mn3+)③溶液呈紫红色 过量的Mn2+能与反应生成的MnO4-反应,影响实验现象的观察
解析
若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒,则依据图象分析判断,MnO42-在MnO4-和MnO2之间;将Mn3+歧化反应得到Mn2+和MnO2,2Mn3++2H2O=MnO2+Mn2++4H+,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;MnO4-溶液中呈紫红色,检验时必须控制Mn2+浓度和用量不能过大过量的Mn2+能与反应生成的MnO4-反应,影响实验现象的观察;
考查方向
解题思路
软锰矿主要成分为MnO2,还含有CaCO3、Fe2O3、Al2O3等杂质,还原焙烧主反应为:2MnO2+C═2MnO+CO2↑.加入硫酸酸浸过滤后的溶液中加入二氧化锰氧化亚铁离子,加入10%的氢氧化镍溶液调节溶液PH4.5使铁离子全部沉淀,过滤后的滤液中加入Na2S沉淀重金属离子可以除去Pb2+、Al3+等离子,滤液中加入碳铵发生复分解反应生成碳酸锰,分离烘干得到成品,①若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线左上方,则该微粒不稳定并发生歧化反应,转化为相邻价态的微粒,则依据图象分析判断,MnO42-在MnO4-和MnO2之间;②将Mn3+歧化反应得到Mn2+和MnO2,2Mn3++2H2O=MnO2+Mn2++4H+,平衡常数等于生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积;③MnO4-溶液中呈紫红色,检验时必须控制Mn2+浓度和用量不能过大过量的Mn2+能与反应生成的MnO4-反应,影响实验现象的观察;
易错点
物质分离提纯和实验基本操作,离子性质、难溶物质溶度积常数的计算、氧化还原反应实质理解,注意图象的理解应用
某实验研究小组欲检验草酸晶体分解的产物并测定其纯度(杂质不发生反应)。查阅资
料:草酸晶体( H2C204·2H20) l00℃开始失水,101. 5C熔化,150℃左右分解产生H2O、CO和
C02。下面是可供选择的实验仪器(图中某些加热装置已略去),实验所需药品不限。
8. 最适宜加热分解革酸晶体的装置是C。若选装置A可能会造成的后果是 ;
若选装置B可能会造成的后果是 。
9.三种气体检验的先后次序是____(填编号)。
A. CO2 、H2O、CO
B.CO、H2O、CO2
C.H2O、CO2、CO
D.H2O、CO、CO2
10.实验利用装置“G(碱石灰)-F-D(CuO固体)-F”检验CO,则F中盛装的试剂是
__ _,证明含有CO的现象是 ____。
11.把分解装置与装有NaOH溶液的E装置直接组合,测量完全分解后所得气体的体积,
测定ag草酸晶体的纯度。经实验得到气体的体积为V mL(已换算成标准状况),则草酸
纯度的表达式为____ 。
12.请设计实验方案测量草酸二级电离平衡常数Ka2的值: ____,并根据方案中测得的物理量,写出计算Ka2的表达式 。
正确答案
固体药品熔化后会流到试管口
冷凝水会倒流到试管底,造成试管破裂
解析
最适宜加热分解革酸晶体的装置是C.若选装置A可能会造成的后果是固体药品熔化后会流到试管口,若选装置B可能会造成的后果是冷凝水会倒流到试管底,造成试管破裂。
故答案为:固体药品熔化后会流到试管口;冷凝水会倒流到试管底,造成试管破裂
考查方向
解题思路
草酸晶体的熔点低,受热容易熔化,用C装置加热分解革酸晶体,熔融的固体不易流下,适用于加热草酸,若选择装置A加热会使固体熔融物溶化后流到试管口处,若选择装置B分解生成的水会倒流试管底部炸裂试管。
易错点
电离平衡常数掌握不熟
正确答案
C
解析
150℃左右分解产生H2O、CO和C02,三种气体的检验顺序应遵循现象明显且不相互干扰,应先检验水,再检验二氧化碳,最后检验一氧化碳。
故答案为:C
考查方向
解题思路
150℃左右分解产生H2O、CO和C02,三种气体的检验顺序应遵循现象明显且不相互干扰,应先检验水,再检验二氧化碳,最后检验一氧化碳。
易错点
电离平衡常数掌握不熟
正确答案
澄清的石灰水
前一个F中没有浑浊,后一个F中有沉淀;D中固体反应后从黑色变成红色。
解析
实验利用装置“G(碱石灰)﹣F﹣D(CuO固体)﹣F”检验CO,通过装置G吸收水和二氧化碳,通过装置F检验二氧化碳是否除净,通过装置D检验是否有一氧化碳含有氧化铜为铜,最后通过装置F检验是否生成二氧化碳气体。
故答案为:澄清的石灰水;前一个F中没有浑浊,后一个F中有沉淀,D中固体反应后从黑色变成红色
考查方向
解题思路
实验利用装置“G(碱石灰)﹣F﹣D(CuO固体)﹣F”检验CO,通过装置G吸收水和二氧化碳,通过装置F检验二氧化碳是否除净,通过装置D检验是否有一氧化碳含有氧化铜为铜,最后通过装置F检验是否生成二氧化碳气体。
易错点
电离平衡常数掌握不熟
正确答案
解析
反应的化学方程式为:H2C2042H203H2O+CO+C02,实验得到气体的体积为VmL(已换算成标准状况),为一氧化碳,物质的量和草酸晶体物质的量相同,n(H2C2042H20)=n(CO)=mol/L,
草酸纯度的表达式=
故答案为:
考查方向
解题思路
草酸晶体(H2C2042H20)l00℃开始失水,101.5C熔化,150℃左右分解产生H2O、CO和C02.反应的化学方程式为:H2C2042H203H2O+CO+C02,实验得到气体的体积为VmL(已换算成标准状况),为一氧化碳,物质的量和草酸晶体物质的量相同,据此计算。
易错点
电离平衡常数掌握不熟
正确答案
常温时,用pH计测量0.100 mol/L 草酸钠溶液的pH,则c(OH-)=Kw/c(H+)
依据 C2O42-+H2O
或

解析
常温时,用pH计测量0.100mol/L草酸钠溶液的pH,则c(OH-)=Kw/c(H+)
依据 C2O42-+H2O
或

考查方向
解题思路
常温时,用pH计测量0.100mol/L草酸钠溶液的pH,依据水解平衡C2O42﹣+H2O?HC2O4﹣+OH﹣,计算平衡常数。
易错点
电离平衡常数掌握不熟
6.下列实验操作、现象与结论对应关系正确的是( )
正确答案
解析
A项酸性条件下NO3—被Fe2+还原为NO,B项含有酚酞的Na2CO3溶液,因碳酸根离子水解显碱性溶液变红,加入少量BaC12固体,水解平衡逆向移动,则溶液颜色变浅,证明Na2CO3溶液中存在水解平衡,故B正确;C项由于起始时,HX、HY等体积等PH值,HX放出的氢气多且反应速率快,说明HX浓度比HY大, 即HX酸性比HY弱,该选项错误。D.等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大,可比较亚硫酸与碳酸的酸性,因亚硫酸不是最高价含氧酸,则不能比较非金属性的强弱,故D错误
考查方向
解题思路
对操作与实现合理分析,每一结论与现象是否吻合。
易错点
等体积,等PH的两酸,是越弱反应速度越快。
知识点
【化学选修——化学与生活】
铝是一种重要的金属,在生产、生活中具有许多重要的用途,如下框图是从铝土矿中制备铝的工艺流程:
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;②溶液中的硅酸钠与偏铝酸钠反应,能生成硅铝酸盐沉淀,化学方程式为: 2Na2SiO3+2NaAlO2+4H2O=Na2Al2Si2O8↓+2H2O+4NaOH
回答下列问题:
21.溶解铝土矿时,发生反应的离子方程式为 、 ________。
22.滤渣A的主要成分是 ;硅铝酸盐沉淀写成氧化物的形式是 。
23.在工艺流程第三步中,选用二氧化碳作酸化剂而不使用盐酸的原因是 。
24.若该工厂用mkg铝土矿共制得nkg Al(假设每步反应进行完全),则铝土矿中Al2O3的质量分数为 。
25.若将铝溶解,下列试剂中最好选用 (填编号)。
A.浓硫酸
B.稀硫酸
C.稀HNO3
D.浓HNO3
26.电解冶炼铝时用Na3AlF6作助熔剂,Na3AlF6是配合物,其中内界是 ,配位数为 。
正确答案
2OH-+Al2O3=2AlO2-+H2O
SiO2+2OH-=SiO32-+H2O
解析
铝土矿中氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,离子方程式:2OH﹣+Al2O3═2AlO2﹣+H2O;
二氧化硅为酸性氧化物,与氢氧化钠反应生成硅酸钠和水,离子方程式:SiO2+2OH﹣═SiO32﹣+H2O
考查方向
解题思路
铝土矿中氧化铝、二氧化硅能够与氢氧化钠反应
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
Fe2O3、Na2Al2Si2O8
Na2O·Al2O3.·2SiO2
解析
依据铝土矿主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,铝土矿中氧化铝、二氧化硅能够与氢氧化钠反应分别生成偏铝酸钠和硅酸钠,氧化铁不与氢氧化钠反应,依据2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH,可知还生成Na2Al2Si2O8,则滤渣A的主要成分为Fe2O3、Na2Al2Si2O8;硅酸盐改写为氧化物的形式一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物,所以Na2Al2Si2O8改写为氧化物为Na2O•Al2O3•2SiO2
考查方向
解题思路
依据铝土矿主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,结合氧化铝、二氧化硅性质判断滤渣成分;硅酸盐改写为氧化物的形式一般方法归纳为:碱性氧化物、两性氧化物、酸性氧化物
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
Al(OH)3溶于强酸而不溶于弱酸,提高Al2O3的提取率(或合理答案)
解析
反应后溶液含有大量偏铝酸钠溶液,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3,若选用盐酸,则生成的氢氧化铝会溶于过量的盐酸,所以第三步中选用二氧化碳作酸化剂。
考查方向
解题思路
依据氢氧化铝能够溶于强酸,不溶液弱酸的性质解答。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
5100n/27m% 或1700n/9m%
解析
设铝土矿中氧化铝为xkg,
2Al~~~~Al2O3
27×2 102
nkg xkg
则x=
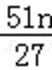
铝土矿中Al2O3的质量分数为
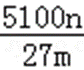
考查方向
解题思路
根据铝元素守恒由Al的质量计算出氧化铝的质量,再求出质量分数。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
B
解析
浓硫酸、浓硝酸具有强的氧化性,能够使铝钝化,不能用来溶解铝,铝与稀硝酸反应生成硝酸铝和一氧化氮和水,一氧化氮有毒,铝与稀硫酸反应生成硫酸铝和氢气,可以用来溶解铝,故选B
考查方向
解题思路
浓硫酸、浓硝酸具有强的氧化性,能够使铝钝化,铝与稀硝酸反应生成硝酸铝和一氧化氮和水,与稀硫酸反应生成硫酸铝和氢气。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
正确答案
[AlF6]3-
6
解析
中心离子和配体组成內界,其余部分为外界,则Na3AlF6中Na+为外界,[AlF6]3-为內界;配原子的数目即是配位数,所以配位数为6
考查方向
解题思路
中心离子和配体组成內界,其余部分为外界;配原子的数目即是配位数。
易错点
本题为工艺流程题,设计物质的分离与提纯、离子方程式书写、有关方程式计算,题目综合性较强,熟悉铝及其化合物性质是解题关键,题目难度较大。
7.我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
正确答案
解析
从文字叙述可以看出是从浓酒中分离出乙醇,是利用酒精与水的沸点不同,用蒸馏的方法将其分离提纯,因此答案选择C。
考查方向
解题思路
把握关键的信息,排除干扰。
易错点
借用古籍记载,学生阅读时不理解其中的意义。
知识点
氮的化合物在生产生活中广泛存在。
25.①氯胺(NH2Cl)的电子式为 。可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如右表所示(假定不同物质中同种化学键的键能一样),则上述反应的ΔH= 。
②NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为 。
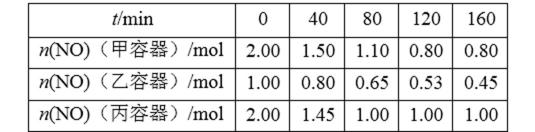
26.用焦炭还原NO的反应为:2NO(g)+C(s)
①该反应为 (填“放热”或“吸热”)反应。
②乙容器在200 min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)= 。
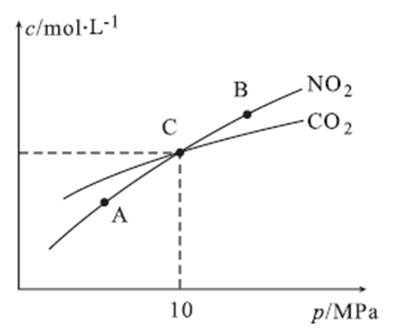
27.用焦炭还原NO2的反应为:2NO2(g)+2C(s)
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)= (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
正确答案
① ;+11.3 kJ•mol-1②NH2Cl+H2O NH3+HClO
解析
①氯胺为共价化合物电子式为: 。反应热=反应物的总键能-生成物的总键能:
即ΔH=[391.3×3+243-(391.3×2+191.2)-431.8]KJ.mol^(-1)=11.3 KJ.mol^(-1)
②由信息可知NH2Cl与水反应生成强氧化性的物质为HClO,反应式为NH2Cl+H2O NH3+HClO
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
正确答案
①放热;②0.003 mol•L-1•min-1。
解析
对比图表数据中的甲与丙,在起始物相同时,丙建立平衡的时间短,由此说明,丙的反应温度更高,反应速度更快。再对比建立平衡后甲容器中NO的量更低,说明低温更有利于NO的转化,因此该反应为放热反应。
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
正确答案
①=(1分) ②A
③2 MPa
解析
①A、B两点温度相同,所以Kc(A)=Kc(B)
②因为2NO2(g)+2C(s)
③在C点c(NO2)=c(CO2)即1-2x=2x,可计数出x=0.25mol,
考查方向
解题思路
本题是化学选修4知识的综合题,考查的内容相当广泛。加强对相关内容的复习是相当有必要的,解题时根据所涉及到的考题,联想到相关的知识。
易错点
利用键能计算反应热,及平衡的计算
H2S、SO2在工农业生产中具有重要应用。
14.羰基硫(COS)可作粮食熏蒸剂

①羰基硫的电子式为____________________;
②下列能说明碳与硫两元素非金属性相对强弱的是____________(填序号)。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.S与H2的化合比C与H2的化合更容易
15.H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,写出该反应的化学方程式______________。
16.H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。
①pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
②某溶液含0.010 mol·L-1Fe2+、未知浓度的Mn2+和0.10 mol·L-1H2S,当溶液pH=___时,Fe2+开始沉淀;当Mn2+开始沉淀时,溶液中
【已知:KSP(FeS)=1.4×10-19,KSP(MnS)=2.8×10-13】
17.用图所示装置可将SO2转化为重要的化工原料,A、B是惰性电极。则电子流入的电极为_______(用A或B表示),A极的电极反应式为__________________
正确答案
(1)①
解析
(1)①羰基硫中分子中所有原子的最外层都满足8电子结构,碳原子能形成4个共价键,硫原子能形成2个共价键,氧原子能形成2个共价键,所以其电子式为

a.相同条件下水溶液的pH:Na2CO3>Na2SO4,说明碳酸的酸性强于硫酸,碳酸和硫酸为C和S元素的最高价氧化物对应的水化物,则证明非金属性S>C,故a正确;
b.酸性:H2SO3>H2CO3,由于亚硫酸不是S元素的最高价氧化物对应的水化物,无法比较二者的非金属性大小,故b错误;
c.CS2中碳元素为+4价,硫元素为-2价,说明硫元素对共用电子对的吸引力较强,说明非金属性:S>C,故c正确;
故答案为:ac;
考查方向
解题思路
(1)①根据羰基硫分子结构和CO2相似,羰基硫分子中所有原子的最外层都满足8电子结构判断其电子式;
②利用氢化物稳定性、最高价氧化物水化物酸性及得电子能力比较非金属性;
易错点
坐标系中给出的信息较多,学生结合沉淀溶解平衡的知识回答,容易出现错误。
正确答案
(2)5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O;
解析
(2)H2S具有还原性,在酸性条件下,能与KMnO4反应生成S、MnSO4、K2SO4和H2O,该反应的化学方程式为5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O,
故答案为:5H2S+2KMnO4+3H2SO4=5S↓+2MnSO4+K2SO4+8H2O;
考查方向
解题思路
(2)由反应物、生成物及电子守恒书写化学反应;
易错点
坐标系中给出的信息较多,学生结合沉淀溶解平衡的知识回答,容易出现错误。
正确答案
(3)①0.043 ②2 ③2×106
解析
(3)①根据溶液pH与c(S2-)关系图pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,故答案为:0.043;
②当Qc=KSP(FeS)时开始沉淀,所以c(S2-)= Ksp(FeS)/c(Fe2+)= 1.4×10-19/0.010mol/L=1.4×10-17mol/L,结合图象得出此时的pH=2,所以pH=2时Fe2+开始沉淀,故答案为:2;
当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)= Ksp(MnS)/c(Mn2+)= 2.8×10-13/0.010mol/L=2.8×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀。c(Mn2+)/c(Fe2+)=2.8×10-11mol/L /1.4×10-17mol/L=2×106;
考查方向
解题思路
(3)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(FeS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;再一次根据当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,然后求c(Mn2+)/c(Fe2+)即可求出答案。
易错点
坐标系中给出的信息较多,学生结合沉淀溶解平衡的知识回答,容易出现错误。
正确答案
(4)B SO2+2H2O-2e-=SO42-+4H+
解析
(4)①由图可知,左侧SO2失去电子转化为SO42-,右侧O2只得到电子,则右侧为正极,A极为负极,电子从A极流出,B为电子流入的一极。由原电池的知识可知,负极发生氧化反应,失去电子,溶液为50% H2SO4,由此可知A极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+。
考查方向
解题思路
(4)由图可知,右侧O2得到电子,则右侧为正极,A极为负极,电子从A极流出.由原电池的知识可知,负极发生氧化反应,失去电子,再根据溶液的酸碱性即可写出电极方程式。
易错点
坐标系中给出的信息较多,学生结合沉淀溶解平衡的知识回答,容易出现错误。
发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃刹。
18.肼易溶于水,它是与氨类似的弱碱,用电离方程式表示肼的水溶液显碱性的原因_________________________。
19.已知:2 N2H4 (1)+ N2O4 (1)===3N2(g)+4H2O(1) △H=-1225 kJ·mol-1
断开1 mol下列化学键吸收的能量分
则使1 mol N2O4 (1)分子中化学键完全断裂时需要吸收的能量是_________________
20.已知N2O4 (1)

②前10 min内用NO2表示的反应速率为_____,20 min时改变的条件是_____;重新达到平衡时,NO2的百分含量 _________(填序号)a.增大 b.减小 C.不变 d.无法判断
21.已知:在相同条件下N2H4·H2O的电离程度大于
N2H5C1的水解程度。常温下,若将0.2 mo1·L-1N2H4·H2O溶液与0.1 mol·L-1HCl溶液等体积混合,则溶液中N2H5+、Cl-、OH-、H+离子浓度由大到小的顺序为_____________。
正确答案
(1)N2H4+H2O⇌N2H+5+OH-
解析
(1)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O⇌N2H+5+OH-;故答案为:N2H4+H2O⇌N2H+5+OH-;
考查方向
解题思路
(1)N2H4结合H2O电离的氢离子使溶液呈碱性;
易错点
等效平衡的建立及离子浓度大小的比较。
正确答案
(2)1793kJ
解析
(2)设1mol N2O4(1)完全分解成相应的原子时需要吸收的能量QKJ,则:190kJ/mol×2+390kJ/mol×8+QkJ/mol-946kJ/mol×3-460kJ/mol×8=-1225 kJ/mol,解得Q=1793,故答案为:1793kJ;
考查方向
解题思路
(2)反应热=反应物总键能-生成物总键能;
易错点
等效平衡的建立及离子浓度大小的比较。
正确答案
(3)①NO2 0.9
②0.04mol/(L.min) 向容器中加入0.8molNO2 b
解析
(3)①X、Y的起始浓度分别为0.2mol/L、0.6mol/L,10min时到达平衡,X浓度增大了0.4mol/L、Y的浓度减小0.2mol/L,由于NO2、N2O4与按物质的量2:1反应,则X为NO2、Y为N2O4;平衡常数K=c2(NO2)/c(N2O4)=0.62/0.4=0.9;
②v(NO2)=(0.6mol/L-0.2mol/L)/10min=0.04mol/(L.min);20min时,Y(N2O4)的浓度不变,X(NO2)的浓度增大,改变的条件应是增大NO2的浓度,等效为增大压强,平衡向生成N2O4的向逆反应进行,减少2molNO2的同时混合气体总物质的量减小1mol,则混合气体中NO2的百分含量减小,故答案为:0.04mol/(L.min);向容器中加入0.8molNO2;b;
考查方向
解题思路
(3)①X、Y的起始浓度分别为0.2mol/L、0.6mol/L,前10min内,X浓度增大了0.4mol/L、Y的浓度减小0.2mol/L,由于NO2、N2O4与按物质的量2:1反应,则X为NO2、Y为N2O4;平衡常数K=c2(NO2)/c(N2O4),代入物质的浓度计算;②根据v=△c/△t,计算v(NO2);20min时,Y(N2O4)的浓度不变,X(NO2)的浓度增大,改变的条件应是增大NO2的浓度,等效为增大压强,平衡向生成N2O4的向逆反应进行,减少2molNO2的同时混合气体总物质的量减小1mol,则混合气体中NO2的百分含量减小;
易错点
等效平衡的建立及离子浓度大小的比较。
正确答案
(4)c(N2H5+)>c(Cl-)>c(OH-)>c(H+)
解析
(4)若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,得到物质的浓度相等N2H5C1和N2H4•H2O,而在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度,所以离子浓度大小为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
考查方向
解题思路
(4)若将0.2mo1•L-1N2H4•H2O溶液与0.1mol•L-1HCl溶液等体积混合,得到物质的浓度相等N2H5C1和N2H4•H2O,而在相同条件下N2H4•H2O的电离程度大于N2H5C1的水解程度,所以离子浓度大小为:c(N2H5+)>c(Cl-)>c(OH-)>c(H+).
易错点
等效平衡的建立及离子浓度大小的比较。
以A(C2H2)为原料合成食用香料E和吡咯(pyrrole)的路线如图所示,部分反应条件及产物略去。其中D在一定条件下可被氧化成酮。
回答下列问题:
28.A的名称是 ;已知C是反式产物,则C的结构简式为 。
29.⑥的反应类型是 ,⑧的反应类型是 。
30.F含有的官能团的名称是 。
31.反应⑤的化学方程式为 。
32.肉桂酸(
33.参照上述合成路线,设计一条由A和乙醛为起始原料制备2,5-二甲基吡咯
(
正确答案
乙炔
解析
由A的分子为C2H2,所以A为乙炔。B的结构简式为:

考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
加成反应;氧化反应。
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
碳碳双键;羟基
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
7种;CH3CH2OCH2CH3
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
正确答案
解析
考查方向
解题思路
对所给的信息要充分把握,学会知识的迁移。加强有机化学基本知识的掌握。
易错点
陌生的有机化学反应不懂其反应原理推断出现障碍,对相关信息的解读能力不足。
1.《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行与世”的描述,对上文进行的某些分析中正确的是()
正确答案
解析
由题中所给信息可知,“洧水”就是石油。
A.“洧水”的主要成分是石油,石油是各种烃的混合物,而油脂是油和脂肪的简称。
B.“洧水”的主要成分是石油,煤油在自然界很难找到。故B错误。
C.石油中含碳量较高,燃烧不充分,所以产生较浓的烟。烟的主要成分为因未充分燃烧而产生的炭黑。故C正确。
D.烟的主要成分碳的颗粒,不是石墨,故D错误。
考查方向
解题思路
本题中“洧水”主要成分为石油,根据石油性质进行解题即可。
易错点
混淆烃和酯的概念。
知识点
2.分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是()
正确答案
解析
A.分枝酸分子中含有-COOH,可与醇发生酯化反应,-OH可以与羧酸发生酯化反应。故反应类型均为酯化反应,反应类型相同。故A正确。
B.1 mo1分枝酸最多可与2 mol NaOH发生中和反应。分枝酸分子中的环不是苯环,羟基不是酚羟基,而是醇羟基,不能与NaOH发生中和反应。所以2个羧基最多能2 mol NaOH发生中和反应,不是3mol NaOH。故B错误。
C.根据结构简式确定分枝酸分子的分子式为C10H10O6。故C错误。
D.分枝酸分子中含有羧基、醇羟基、双键、醚键4种官能团。故D错误。
考查方向
解题思路
掌握有机物中各官能团与性质的关系是解题的关键。
易错点
将醇羟基当成了酚羟基,误选B选项。
知识点
扫码查看完整答案与解析