- 常见无机物及其应用
- 共1311题
14.氢化热是指一定条件下,1 mol不饱和化合物加氢时放出的热量。表中是环己烯(

根据表中数据推断正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.氢气和氨气都属于无碳清洁能源。
(1)某些合金可用于储存氢,金属储氢的原理可表示为:
M(s)+xH2
下图表示温度分别为T1、T2时,最大吸氢量与氢气压强的关系。则下列说法中,正确的是_____________
a.T1>T2
b.增大氢气压强,加快氢气的吸收速率
c.增大M的量,上述平衡向右移动
d.在恒温、恒容容器中,达平衡后充入H2,再次平衡后的压强增大
(2)以熔融碳酸盐为电解质,稀土金属材料为电极组成氢氧燃料电池(如装置甲所示),其中负极通入H2,正极通入O2和CO2的混合气体。乙装置中a、b为石墨电极,电解过程中,b极质量增加。
①工作过程中,甲装置中d电极上的电极反应式为_____________________________。
②若用该装置电解精炼铜,则b极接____(填“粗铜”或“精铜”);若用该装置给铁制品上镀铜,则____(填“a”或“b”)极可用惰性电极(如Pt电极),若电镀量较大,需要经常补充或更换的是_______。
(3)氨在氧气中燃烧,生成水和一种空气组成成分的单质。
已知:N2(g)十3H2(g)

2H2(g)十O2(g)=2H2O(1) △H=
试写出氨气在氧气中燃烧生成液态水的热化学方程式___________________。
(4)在一定条件下,将lmotN2和3molH2混台于一个10L的密闭容器中发生反应:
5min后达到平衡,平衡时氮气的转化率为
①该反应的平衡常数K=________,(用含
②从反应开始到平衡时N2的消耗速率v(N2)=____mo1·L-1·min-1。(用含
正确答案
(1)b
(2)
①O2+4e-+2CO2=2CO32-
②精铜 a CuSO4溶液
(3)4NH3(g)+ 3O2(g)=2N2(g)+6H2O(l) △H=-1531.2kJ·mol-1
或2NH3(g)+ 3/2O2(g)=N2(g)+3H2O(l) △H=-765.6.kJ·mol-1
(4)
①400α2/27(1-α)4
②0.02α
解析
解析已在路上飞奔,马上就到!
知识点
9.X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的金属性最强,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
12.下列根据实验操作和现象所得出的结论都正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
29.对氮、碳及其化合物的研究具有重要意义。
(1)用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)=N2O4(g) △H1 K1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H2 K2
则2N2H4(g)+ N2O4(g)=3N2(g)+4H2O(g) △H=__________(用△H1、△H2表示),该反应的化学平衡常数K =__________(用K1、K2表示)
(2)汽车尾气转化反应:NO+CO→N2+CO2(未配平),将NO和CO转化为和N2 和CO2,实现除污,每生成1molN2还原剂失去电子数为__________。
(3) 大气污染物氮氧化

①0~10min内,NO的平均反应速率v(
T1℃时,该反应的平衡常数K=____________________。
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能
是__________(填字母编号)。
a.加入一定量的活性炭
b.通入一定量的NO
c.恒容时,充入一定量的氦气
d.加入合适的催化剂
(4) 氨燃料电池使用的电解质溶液是2 mol·L-1的KOH溶液,电
(5) 实验室中用NaOH溶液吸收CO2,发生反应为2CO2+3NaOH=Na2CO3+NaHCO3+H2O。所得混合液中所有离子浓度由大到小的顺序为__________。
正确答案
(1) 2△H2 ―△H1 K2 2/K1
(2)4NA或4×6.02×1023
(3)①0.042mol·L-1·min-1 , 0.56(或
(4) O2+2H2O+4e-=4OH-
(5)
解析
解析已在路上飞奔,马上就到!
知识点
2.下列关于乙醇的说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
16.两份质量相等的Na2O2和NaHCO3混合物,其中一份加入足量的盐酸充分反应后放出2.24L(标准状况)的气体;将这些气体通入另一份混合物中使其充分反应,气体体积变为2.016L(标准状况)。则原混合物中Na2O2和NaHCO3的物质的量之比可能为( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
9.下列事实不能用勒夏特列原理解释的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
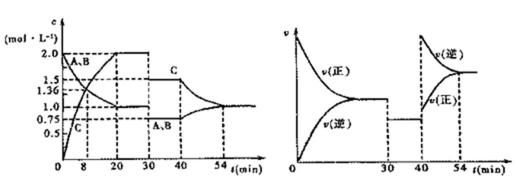
18.某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应: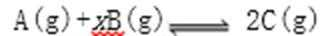
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
6.下列反应Ⅰ和反应Ⅱ属于同一种反应类型的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
7. FeCl3溶液与KSCN溶液混合时存在下列平衡:Fe3+(aq)+SCN﹣(aq)⇌Fe(SCN)2+(aq) 已知某一条件下,反应达到平衡时,Fe(SCN)2+的物质的量浓度与温度的关系如图所示,下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
14.利用下列实验器材(规格和数量不限),不能完成相应实验的选项是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
25.下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水
②提高部分产品的质量
③优化提取产品的品种
④改进钾.溴.镁的提取工艺
26.采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O—NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
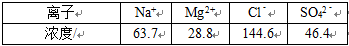
27.海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
28.8g m[Mg(OH)2]
m[Mg(OH)2]=28.8g×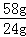
故答案为:Ca2++SO42﹣=CaSO4↓;Mg(OH)2;69.6;
正确答案
②③④
解析
①混凝法是加入一种混凝剂,使水中细小的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,海水中可溶性杂质不能除去,不能进行海水淡化,故①错误;
②改进工艺,尽可能减少新物质引入,除去粗产品中的杂质,可以提高产品的质量,故②正确;
③海洋是一个远未完全开发的巨大化学资源宝库,海水中元素种类很多,改进工艺可以优化提取产品的品种,故③正确;
④根据不同的提取原理可以改进钾、溴、镁等的提取工艺,从而提高K、Br2、Mg等的提取质量,故④正确;
故选:②③④;
考查方向
解题思路
混凝法使的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,不能进行海水淡化,通过改变工艺,可以提高部分产品的质量,优化提取产品的品种,可以根据不同的原理改进钾、溴、镁等的提取工艺;
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg2计算氢氧化镁的质量;
电解熔融氯化镁得到Mg与氯气;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗.
易错点
本题考查海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,题目难度中等。
正确答案
解析
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂=2×5×n还原剂,故n氧化剂:n还原剂=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×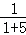
考查方向
海水资源及其综合利用;原电池和电解池的工作原理。
解题思路
混凝法使的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,不能进行海水淡化,通过改变工艺,可以提高部分产品的质量,优化提取产品的品种,可以根据不同的原理改进钾、溴、镁等的提取工艺;
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg2计算氢氧化镁的质量;
电解熔融氯化镁得到Mg与氯气;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗.
易错点
本题考查海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,题目难度中等。
正确答案
Ca2++SO42﹣=CaSO4↓;Mg(OH)2;69.6;
解析
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,用Ca2+沉淀SO42﹣生成CaSO4沉淀,离子方程式为:Ca2++SO42﹣=CaSO4↓,采用过滤的方法得到产品1为CaSO4,滤液中加入石灰乳,发生反应为Mg2++2OH﹣=Mg(OH)2↓,合成中应得到Mg(OH)2沉淀,过滤、干燥的产品2为Mg(OH)2,溶液中m=1L×28.8g/L=28.8g,
Mg2+~Mg(OH)2
24g 58g
考查方向
海水资源及其综合利用;原电池和电解池的工作原理。
解题思路
混凝法使的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,不能进行海水淡化,通过改变工艺,可以提高部分产品的质量,优化提取产品的品种,可以根据不同的原理改进钾、溴、镁等的提取工艺;
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg2计算氢氧化镁的质量;
电解熔融氯化镁得到Mg与氯气;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗.
易错点
本题考查海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,题目难度中等。
正确答案
28.采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
MgCl2
Mg+2H2O
解析
电解熔融氯化镁得到Mg与氯气,电解反应方程式为:MgCl2

故答案为:MgCl2

考查方向
解题思路
混凝法使的悬浮物质和胶体聚集成较大颗的颗粒而沉淀,然后过滤除去,不能进行海水淡化,通过改变工艺,可以提高部分产品的质量,优化提取产品的品种,可以根据不同的原理改进钾、溴、镁等的提取工艺;
反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
工艺流程合成步骤中加入石灰乳,沉降后,将过滤后的滤液进行脱硫,应是用钙离子沉淀硫酸根离子生成硫酸钙沉淀,产品1为硫酸钙,合成得到氢氧化镁沉淀,故过滤后干燥的产品2为氢氧化镁,计算1L溶液中Mg2+的质量,根据Mg2+~Mg2计算氢氧化镁的质量;
电解熔融氯化镁得到Mg与氯气;电解时,若有少量水存在,Mg与水反应生成氢氧化镁与氢气,会造成产品镁的消耗.
易错点
本题考查海水资源开发利用、氧化还原反应计算、电解原理等,是对基础知识的综合运用,需要学生具备扎实的基础,题目难度中等。
【化学——选修2:化学与技术】
硅是无机非金属材料的主角,硅芯片的使用,促进了信息技术的革命。
23.陶瓷、水泥和玻璃都属于传统硅酸盐材料。其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还有__________。玻璃制作过程中发生了Na2CO3+SiO2
24.工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
①请写出反应Ⅱ、Ⅲ的化学方程式:Ⅱ_________、Ⅲ___________。
②在流化床反应的产物中,SiHCl3大约占85%,所含有的其它物质的沸点数据如下表:
提纯SiHCl3的主要工艺操作依次是沉降、冷凝和分馏(相当于多次蒸馏)。沉降是为了除去____________;在空气中冷凝所得液体主要含有____________;若在实验室进行分馏提纯该液体,应该采取以下加热方法中的___________。
A.电炉加热
B.酒精灯加热
C.砂浴加热
D.水浴加热
③SiHCl3极易水解,其完全水解时的反应方程式为_____________。
正确答案
CaCO3 高温下Na2SiO3的稳定性比Na2CO3强
解析
陶瓷、水泥和玻璃都属于传统硅酸盐材料。其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还有CaCO3。虽然碳酸酸性强于硅酸,但是高温下Na2SiO3的稳定性比Na2CO3强,因此玻璃制作过程中发生了Na2CO3+SiO2
考查方向
解题思路
陶瓷、水泥和玻璃都属于传统硅酸盐材料。其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还有CaCO3。虽然碳酸酸性强于硅酸,但是高温下Na2SiO3的稳定性比Na2CO3强;
易错点
本题考查硅酸盐工业,难度较小,主要考查学生对硅酸盐工业的了解,体现化学的社会作用,以识记为主,加强基础知识的掌握。
正确答案
①Si +3HCl 

②Si SiCl4和SiHCl3 D
③SiHCl3+4H2O =H4SiO4+ H2↑+3HCl↑(或H2SiO3)
解析
①工业上提纯硅有多种路线,其中一种工艺流程主要反应如下:2C+SiO2


②流化床反应是一种利用气体或液体通过颗粒状固体层而使固体颗粒处于悬浮运动状态,并进行气固相反应过程或液固相反应过程。在流化床反应的产物中,SiHCl3大约占85%,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和分馏(相当于多次蒸馏)。沉降是为了除去Si(固体);在空气中冷凝,SiCl4和SiHCl3液化;若在实验室进行分馏提纯该液体,温度在31.8-57.6℃之间,应该采取水浴加热方法加以分离,故选D;
③SiHCl3极易水解,其完全水解时生成H2、HCl、H2SiO3,反应方程式为SiHCl3+4H2O =H4SiO4+ H2↑+3HCl↑(或H2SiO3)。
考查方向
解题思路
①工业上提纯硅有多种路线,其中一种工艺流程主要反应如下:2C+SiO2


②流化床反应是一种利用气体或液体通过颗粒状固体层而使固体颗粒处于悬浮运动状态,并进行气固相反应过程或液固相反应过程。在流化床反应的产物中,SiHCl3大约占85%,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和分馏(相当于多次蒸馏)。沉降是为了除去Si(固体);在空气中冷凝,SiCl4和SiHCl3液化;若在实验室进行分馏提纯该液体,温度在31.8-57.6℃之间,应该采取水浴加热方法加以分离;
③SiHCl3极易水解,其完全水解时生成H2、HCl、H2SiO3。
易错点
本题考查硅酸盐工业,难度较小,主要考查学生对硅酸盐工业的了解,体现化学的社会作用,以识记为主,加强基础知识的掌握。
10.《常用危险化学用品贮存通则》规定:“遇火、遇热、遇潮能引起燃烧、爆炸或发生化学反应,产生有毒气体的化学危险品不得在露天或在潮湿、积水的建筑物中贮存”。下列解释事实的方程式中,不合理的是
正确答案
解析
A、氮气和氧气反应的条件是光照或高温;
B、硝酸铵在加热时生成氮气、氧气和水蒸气;
C、干燥的氯化铝遇水发生水解,当生成氯化氢气体时氯化铝的水解完全;
D、电石的主要成分碳化钙与水反应生成氢气同时放出大量热,会发生爆炸。
考查方向
本题主要考查了元素及其化合物的化学性质。
解题思路
A、条件是光照或高温;
B、硝酸铵在加热时生成氮气、氧气和水蒸气;
C、干燥的氯化铝遇水发生水解;
D、电石的主要成分碳化钙。
易错点
氮气和氧气反应的条件是光照或高温、干燥的氯化铝遇水发生水解。
知识点
扫码查看完整答案与解析