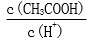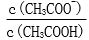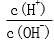- 常见无机物及其应用
- 共1311题
18. 氮元素在海洋中的循环,是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用下图表示。
(1)海洋中的氮循环起始于氮的固定,其中属于固氮作用的一步是__________(填图中数字序号)。
(2)下列关于海洋氮循环的说法正确的是_________(填字母序号)。
a. 海洋中存在游离态的氮
b. 海洋中的氮循环起始于氮的氧化
c. 海洋中的反硝化作用一定有氧气的参与
d. 向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)有氧时,在硝化细菌作用下,NH4+可实现过程④的转化,将过程④的离子方程式补充完整:
NH4+ + 5O2 === 2NO2- + H+ +_________+_________
(4)有人研究了温度对海洋硝化细菌去除氨氮效果的影响,下表为对10 L人工海水样本的监测数据:
硝化细菌去除氨氮的最佳反应温度是_________,在最佳反应温度时,48 h内去除氨氮
反应的平均速率是_________mg·L-1·h-1。
(5)为了避免含氮废水对海洋氮循环系统的影响,需经处理后排放。下图是间接氧化工业废水中氨氮(NH4+)的示意图。
① 结合电极反应式简述间接氧化法去除氨氮的原理:_________________。
② 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH
将_________(填“增大”、“不变”或“减小”),请简述理由:__________________。
正确答案
(1)②
(2) ad
(3)4NH4+ + 5O2 === 2NO2- + 6H+ + N2O + 5H2O
(4)25℃ 1.125
(5)① 阳极反应Cl- -2e- = Cl2 产生的Cl2氧化废水中的NH4+释放出N2
② 减小,理由:电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多。
解析
(1)由图中信息可以看出海洋中的氮循环中属于固氮作用的一步是将N2转化为NH4+的过程,所以是图中的序号②;
(2)同样由图中信息可以看出海洋中存在游离态的氮,所以a正确;且由于向海洋排放含NO3-的废水会反硝化生成N2,而N2可以转化为NH4+,进而影响海洋中NH4+的含量,d正确;海洋中的氮循环起始于N2转化为NH4+的过程,这个过程是氮的还原过程,b错误,海洋中的反硝化作用一定是发生了氧化反应,但是不一定有氧气的参与,c错误;
(3)5个O2反应要转移20个电子,而2NH4+ 转化为2NO2- 转移12个电子,所以还有8个电子则一定有2个 N2O生成,再根据电荷守恒和原子守恒配平并补充H+,即离子方程式为:4NH4+ + 5O2 === 2NO2- + 6H+ + N2O + 5H2O ;
(4)由图中信息可以看出25℃时硝化细菌去除氨氮时氨氮含量最低,所以硝化细菌去除氨氮的最佳反应温度是25℃;在25℃时,48 h内去除氨氮反应的质量为=1008-468=540mg,所以反应速率=[540mg÷(10L)]÷48h=1.125mg·L-1·h-1;
(5)①由图中信息可以看出阳极有Cl2产生,所以阳极的电极反应为:Cl- -2e- = Cl2 ,而废水中的NH4+具有还原性,可以被Cl2氧化N2释放出;
②当电路中通过相同电量时,生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多,所以溶液中H+浓度增大,则溶液的pH减小;
考查方向
以氮元素在海洋中的循环为载体,考查有关图表信息、氮的固定、离子型氧化还原反应方程式的配平、实验条件的控制、反应速率的计算、电化学原理的应用和计算等。
解题思路
(1)由图中信息可以看出海洋中的氮循环中属于固氮作用的一步是将N2转化为NH4+的过程;
(2)同样由图中信息可以看出海洋氮循环的说法正确的是_______(填字母序号)。
a.海洋中存在游离态的氮
b.海洋中的氮循环起始于氮的氧化
c.海洋中的反硝化作用一定有氧气的参与
d.向海洋排放含NO3-的废水会影响海洋中NH4+的含量
(3)4NH4+ + 5O2 === 2NO2- + 6H+ + N2O + 5H2O
(4)25℃ 1.125
(5)① 阳极反应Cl- -2e- = Cl2 产生的Cl2氧化废水中的NH4+释放出N2
② 减小,理由:电路中通过相同电量时,若生成n (H2):n (N2)=3:1,则阳极产生的H+比阴极消耗的H+多。
易错点
不能准确观察和整合题给信息;配平方程式时不能有效使用电荷守恒进行配平;不能根据电子守恒分析电极反应中H+的变化,进而分析pH 的变化。
知识点
14.向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)

正确答案
解析
A.从图中可以看出,随反应进行反应物浓度减小,而正反应速率增大,说明体系温度升高,故正反应是放热反应,所以A正确;B.因为随反应进行反应物浓度减小,故反应物浓度:a点大于b点,b点大于c点,即a>b>c,所以B错误;C.反应在c点,反应速率仍在变化,说明反应仍在进行,故未达到平衡状态,所以C错误;D.在恒温恒容容器中,热量可以散失,所以平衡后容器的温度低于绝热恒容密闭容器中的温度,则在恒温恒容容器中反应进行程度大,SO2的转化率大,所以D错误。
考查方向
解题思路
A.因为随反应进行反应物浓度减小,而正反应速率增大,说明体系温度升高,故正反应是放热反应;B.因为随反应进行反应物浓度减小,故反应物浓度:a点大于b点,b点大于c点;C.反应在c点,反应速率仍在变化,说明反应仍在进行,故未达到平衡状态,D.若在恒温恒容容器中,以相同的投料进行该反应,平衡后容器的温度低于绝热恒容密闭容器中的温度,则在恒温恒容容器中反应进行程度大,SO2的转化率大。
易错点
绝热恒容密闭容器中的温度随着反应的进行要发生变化。
知识点
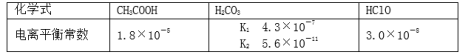
25℃时,三种酸的电离平衡常数如下:
回答下列问题:
25.一般情况下,当温度升高时,Ka ________(填“增大”、“减小”或“不变”).
26.下列四种离子结合
a. CO32-
b. ClO-
c. CH3COO-
d. HCO3-
27.下列反应不能发生的是________(填序号)
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
28.用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填序号);
a.
b.
c.
d.
29.体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。
则HX的电离平衡常数________(填“大于”、“等于”或“小于”,下同)

30.25 ℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中
c(CH3COO-)-c(Na+)=________ mol·L-1(填精确数值)。
正确答案
增大
解析
Ka只跟温度有关,电离过程吸热,温度升高Ka增大。
考查方向
解题思路
Ka代表弱酸电离常数,只跟温度有关,电离过程吸热,利用勒夏特列原理分析即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
a>b>d>c
解析
酸性越弱,对应的酸根离子结合质子(H+)能力越强,因为酸性:CH3COOH> H2CO3> HClO > HCO3-,所以CO32->ClO->HCO3->CH3COO-,即a>b>d>c。
考查方向
解题思路
质子即为H+,结合H+越容易,说明得到的对应的酸越弱,Ka会越小,结合表中Ka值即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
c d
解析
根据强酸制弱酸原理,
反应a:酸性CH3COOH> H2CO3 ,符合;
反应b:酸性CH3COOH> HClO ,符合;
反应c:酸性HClO > H2CO3 ,不符合;
反应d:酸性HCO3-> HClO ,不符合;(因为HClO > HCO3- 故产物不是CO32-而是HCO3-)
考查方向
解题思路
Ka越大,酸性越强,即CH3COOH> H2CO3> HClO > HCO3-,再结合强酸制弱酸原理去分析a、b、c、d四个反应即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
b
解析
CH3COOH溶液中存在两个电离平衡:CH3COOH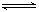



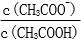
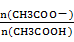
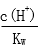
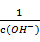
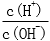
考查方向
解题思路
CH3COOH溶液中存在两个电离平衡:CH3COOH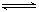

易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
大于;大于; 稀释后HX溶液中的c(H+)小于CH3COOH溶液中的c(H+),它对水的电离的抑制能力减弱
解析
由图可知:稀释前:PH(HX)= PH(CH3COOH)=2,稀释100后: PH(CH3COOH)< PH(HX)<4,说明HX存在电离平衡即为弱酸,但酸性比CH3COOH强,故HX电离平衡常数大于醋酸的电离平衡常数;由于HX自身电离出的H+大于醋酸电离出的H+,根据C(H+)越大对水的电离平衡越抑制,导致水电离的H+浓度越小,故HX溶液中水电离出来的c(H+)小于醋酸溶液中水电离出来的c(H+)。
考查方向
解题思路
由图可知未稀释前PH相同,稀释相同倍数后HX的PH变化大于CH3COOH,说明酸性:HX>CH3COOH,另外这一过程溶液由10ml稀释到1000ml即稀释了100倍,稀释前后HX的PH变化小于2,说明HX是弱酸。其他的根据电离平衡影响因素分析即可。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
正确答案
9.9×10-7 moL·L-1
解析
混合溶液pH=6,说明c(H+)=10-6mol/l,c(OH-)=10-8mol/l,根据电荷守恒:
c(H+)+c(Na+)=c(CH3COO-)+ c(OH-)可得:c(CH3COO-)-c(Na+)=c(H+) -c(OH-)=10-6-10-8mol·L-1=9.9×10-7 moL·L-1
考查方向
解题思路
根据溶液中阴阳离子电荷守恒分析即可得出答案。
易错点
不能熟练运用电离平衡、水解平衡分析解决实际问题。
6.下列关于氮的固定的说法错误的是
正确答案
解析
氮的固定是将游离态的氮转化成化合态的氮,因此必然发生氧化还原反应,自然界的固氮可以转化成氮的氧化物或铵态氮,因此氮元素的化合价在固定过程中极可能别氧化也可能被还原。故选择C
考查方向
解题思路
准确把握氮的固定概念
易错点
概念认知错误
知识点
10.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
正确答案
D
解析
A.铝热反应为放热反应,结论不合理,故A错误;
B.向鸡蛋清溶液中加入饱和(NH4)2SO4溶液发生盐析,而不是变性,重金属盐可使蛋白质变性,故B错误;
C.硫酸钙和碳酸钙阴离子和阳离子比相同,可以直接比较溶解度和溶度积常数,处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解,发生了沉淀转化,Ksp:CaCO3<CaSO4,故C错误;
D.因为NaHCO3的溶解度比Na2CO3的小,所以向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊,有因果关系,故D正确.
故选D.
考查方向
化学实验方案的评价
解题思路
A.铝热反应为放热反应;
B.重金属盐可使蛋白质变性;
C.沉淀向更难溶的方向转化;
D.NaHCO3的溶解度比Na2CO3的小.
易错点
本题不容易把握实验的严密性和可行性的评价。
知识点
10.酸碱质子理论认为凡是能给出质子的离子或分子都是酸;凡是能接受质子的离子或分子都是碱。物质的酸性或碱性强弱
正确答案
解析
A、活泼金属与水发生的氧化还原反应,而不是酸碱反应,故A错误;
B、S2-接受质子是碱,而H2O给出质子是酸,所以S2-+H2O
C、物质碱性的强弱取决于分子或离子接受质子能力的大小,接受质子能力:OH->ClO->CH3COO-,则碱性顺序:OH->ClO->CH3COO-,故C错误;
D、NH3可以结合质子是碱,HCO3-既可以给出质子也可以接受质子,所以既是酸又是碱,故D错误;
考查方向
酸碱质子理论、电离、水解
解题思路
酸碱质子理论:凡是能够给出质子(H+)的物质都是酸、凡是能够接受质子的物质都是碱,所以所有酸都能够释放出H+,能结合H+的都是碱.为酸碱两性物质的是属于酸又属于碱,必须符合能给出质子又能结合质子,据此即可解答
易错点
酸碱质子理论中的酸、碱、两性物质
教师点评
本题考查酸碱质子理论,解答本题关键是要严格按照酸与碱的定义考虑,是能给出质子(H+)还是能接受质子,题目难度不大
知识点
13. 下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是
正确答案
解析
“侯氏制碱法”制取NaHCO3的原理是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3,
为防止倒吸,a管通NH3,b管通CO2,故A、C错误;
由于CO2在水中的溶解度较小,而NH3的溶解度较大,所以要在食盐水先通NH3然后再通CO2,否则CO2通入后会从水中逸出,等再通NH3时溶液中CO2的量就很少了,这样得到的产品也很少,故B正确、D错误;
考查方向
实验装置的综合应用、侯氏制碱法原理
解题思路
“候氏制碱法”制取NaHCO3的原理 是在饱和食盐水中通入氨气和二氧化碳,而得到NaHCO3;在这一实验过程中,由于CO2在水中的溶解度较小,而NH3的溶解度较大,为防止倒吸,b管通CO2,a管通NH3,所以要向食盐水中先通NH3再通CO2,否则CO2通入后会从水中逸出,再通NH3时溶液中CO2的量很少,得到的产品很少;在这个实验中的尾气主要是CO2和NH3,其中NH3对环境影响较大,要进行尾气处理,而NH3是碱性气体,所以在c装置中要装酸性物质,据此进行推断
易错点
常见装置特点及使用方法
教师点评
本题主要考查实验装置的综合应用、侯氏制碱法原理,题目难度中等,明确侯氏制碱法原理为解答关键,试题培养了学生的分析能力及化学实验能力
知识点
11.已知某溶液中含有碳酸钠、硫酸钠、氢氧化钠、氯化钠四种溶质,欲将该溶液中四种溶质的阴离子逐一检验出来,所加试剂先后顺序合理的是
正确答案
解析
先加硝酸,氢离子与碳酸根离子生成气体,可以鉴别出碳酸钠,但硝酸也可和氢氧化钠反应生成水,没有明显现象,又除去了氢氧根离子,故A、B错误;
铵根离子与氢氧根离子反应生成具有刺激性气味的气体,加入硝酸铵可以证明氢氧化钠的存在;再加入稀硝酸,有气体生成,证明含有碳酸钠;加入硝酸钡,钡离子与硫酸根离子生成硫酸钡沉淀,可以证明含有硝酸钡;最后加入硝酸银,银离子与氯离子反应生成氯化银白色沉淀,证明含有氯化钠,可以将四种溶质都证明出来,如先加入硝酸银,则硫酸银、氯化银都生成沉淀,不能鉴别,故C正确、D错误
考查方向
物质的检验和鉴别
解题思路
检验氢氧化钠,可加入铵盐,生成刺激性气味的气体,然后加入硝酸检验碳酸钠,加入硝酸钡检验硫酸钠,过滤后加入硝酸银检验氯化钠,注意加入试剂不能干扰其它离子的,以此解答该题
易错点
所加试剂能否逐一鉴别
教师点评
本题考查物质的检验和鉴别,为高考常见题型,侧重学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握物质的性质的异同以及实验的严密性,难度不大
知识点
1.下列物质的用途不正确的是
正确答案
解析
A.硅导电性介于导体与半导体之间,是良好的半导体材料,故A正确;
B.生石灰具有吸水性,生石灰用作食品干燥剂,不具有还原性,不能做抗氧剂,故B错误;
C.液氨汽化吸收大量的热,具有制冷作用,可做制冷剂,故C正确;
D.亚硝酸盐具有还原性,可做防腐剂,故D正确
考查方向
物质的性质和用途
解题思路
A.硅导电性介于导体与半导体之间;
B.生石灰具有吸水性;
C.液氨汽化吸收大量的热;
D.亚硝酸盐具有还原性
易错点
C项:液氨用作制冷剂
教师点评
本题考查了物质的用途,性质决定用途,明确相关物质的性质是解题关键,题目难度不大
知识点
现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
已知NaHCO3在低温下溶解度较小。
38.反应Ⅰ的化学方程式为________________________________________________。
39.处理母液的两种方法:
(1)向母液中加入石灰乳,反应的化学方程式为 ,目的是使______循环利用。
(2)向母液中 并降温,可得到NH4Cl晶体。
正确答案
NaCl+CO2+NH3+H2O →NaHCO3↓+NH4Cl
解析
由于NaHCO3在低温下溶解度较小,溶液中含有较大浓度的钠离子和碳酸氢根离子时,就会有碳酸氢钠晶体析出
考查方向
纯碱工业
解题思路
NaHCO3在低温下溶解度较小
易错点
NaHCO3为沉淀形式
教师点评
本题考查侯氏制碱法的反应原理,利用低温下NaHCO3溶解度较小而析出,题目不难
正确答案
(1) 2NH4Cl +Ca(OH)2→ CaCl2+ 2NH3↑+2H2O (2分) NH3 (1分)(2)通入NH3,加入细小的食盐颗粒(2分)
解析
(1)根据题中反应流程可知,过滤后得到的母液中含有氯化铵,母液中加入石灰乳后,发生反应为:2NH4Cl +Ca(OH)2→ CaCl2+ 2NH3↑+2H2O,反应生成氨气,氨气可以在反应流程中循环利用
(2)NH3+H2O+CO2+NaCl═NH4Cl+NaHCO3↓及流程图知,母液中溶质为氯化铵,向母液中通氨气加入细小食盐颗粒,冷却析出副产品,通入的氨气和水反应生成一水合氨,一水合氨电离出铵根离子,铵根离子浓度增大有利于析出氯化铵
考查方向
纯碱工业
解题思路
(1)根据流程可知,母液中含有氯化铵,加入石灰乳后可以生成氨气;
(2)根据氨水电离成铵根和氢氧根离子,增大铵根的浓度有利于氯化铵的析出来分析,溶液碱性增强,使碳酸氢钠转换为溶解度较大的碳酸钠
易错点
母液中有利于NH4Cl析出的条件
教师点评
本题考查了侯氏制碱法的流程,注重对流程的分析是解题的关键,难度不大
叶酸可以由下列甲、乙、丙三种物质合成。
42.甲的最简式为 ;丙中含有官能团的名称为 。
43.下列关于乙的说法正确的是 (填序号)。
44.甲在一定条件下能单独聚合成高分子化合物,请写出该反应的化学方程式: 。
45.甲可以通过下列路线合成(分离方法和其他产物已经略去):
(1)步骤Ⅰ的反应类型是 。
(2)步骤I和IV在合成甲过程中的目的是 。
(3)步骤IV反应的化学方程式为 。
正确答案
C7H7 NO2 ;羧基、氨基
解析
根据结构简式确定分子式为C7H7NO2;丙中官能团是氨基和羧基
考查方向
有机物最简式、官能团
解题思路
根据结构简式确定分子式;丙中官能团是氨基和羧基
易错点
官能团的名称
教师点评
本题考查有机物的分子式、官能团,属于基础性知识,题目较简单
正确答案
解析
a.该分子中C、N原子个数分别是7、5,所以分子中碳原子与氮原子的个数比是7:5,故正确;
b.含有苯环的有机物属于芳香族化合物,该分子中没有苯环,所以不属于芳香族化合物,故错误;
c.氨基能和酸反应、氯原子能和碱溶液反应,所以该物质既能与盐酸又能与氢氧化钠溶液反应,故正确;
d.该分子中含有N原子,不属于苯酚的同系物,故错误
考查方向
有机物的结构和性质
解题思路
a.该分子中C、N原子个数分别是7、5;
b.含有苯环的有机物属于芳香族化合物;
c.氨基能和酸反应、氯原子能和碱溶液反应;
d.该分子中含有N原子;
易错点
易错判该结构中含有苯环
教师点评
本题考查有机物的结构与性质,把握官能团与性质的关系为解答的关键,题目难度不大
正确答案
解析
甲中氨基和羧基能发生缩聚反应生成高分子化合物,反应方程式为:
考查方向
有机化学反应
解题思路
甲中氨基和羧基能发生缩聚反应生成高分子化合物
易错点
聚合反应中的n易漏写
教师点评
本题主要考查有机化学反应,根据结构中含有的官能团的性质进行分析,题目难度不大
正确答案
(1)取代反应 (2)保护氨基 (3)
解析
反应I是取代反应、反应II是加成反应、反应III是氧化反应生成戊,醛基被氧化生成羧基,戊水解生成甲,
i.步骤Ⅰ的反应类型是取代反应
ii.步骤 I和 IV在合成甲过程中的目的是保护氨基
iii.IV反应的化学方程式为:
考查方向
有机合成
解题思路
反应I是取代反应、反应II是加成反应、反应III是氧化反应生成戊,醛基被氧化生成羧基,戊水解生成甲
易错点
步骤 I和 IV在合成中的目的
教师点评
本题考查有机合成,明确流程图中发生的反应及反应中断键和成键方式是解本题关键,侧重考查学生分析判断能力,题目难度不大
硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,可溶于水,在100℃~110℃时分解。在定量分析中常用作标定重铬酸钾、高锰酸钾等溶液的标准物质,还用于冶金、电镀等。
化学课外活动小组研究莫尔盐晶体强热时的分解产物。
16.乙组同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2。为进行验证,选用甲组实验中的装置A和下图所示的部分装置进行实验。

15.甲组同学按照如图所示的装置进行研究,装置C中可观察到的现象是__________,由此可知分解产物中有____________。
正确答案
①G D B C F ②吸收氨气并将溶液酸化,排除SO2的干扰 D中出现白色沉淀
解析
①要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,所以装置依次连接的合理顺序为A、G、D、B、C、F;
②由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰,SO3通入氯化钡溶液中可以产生硫酸钡沉淀,二氧化硫能使品红褪色,所以装置D中足量盐酸的作用是 吸收氨气并将溶液酸化,排除SO2的干扰;含有SO3的实验现象是 D中有白色沉淀
考查方向
性质实验方案设计
解题思路
①要检验生成SO3(g)、SO2(g)及N2,在甲组实验中的装置A产生气体后,经过安全瓶后通过氯化钡溶液检验SO3,再通过品红溶液检验SO2,用浓氢氧化钠除去二氧化硫,用排水集气法收集氮气,据此答题;
②由于产生的气体中有氨气,所以氯化钡溶液中加入足量的盐酸,可以吸收氨气并防止产生亚硫酸钡沉淀,排除SO2的干扰,SO3通入氯化钡溶液中可以产生硫酸钡沉淀,二氧化硫能使品红褪色
易错点
各连接装置的作用
教师点评
本题考查性质实验方案设计,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是排列实验先后顺序,根据实验目的及物质的性质进行排列顺序,注意要排除其它因素干扰,题目难度中等
正确答案
溶液变红 NH3
解析
莫尔盐[(NH4)2Fe(SO4)2•6H2O]受热分解,分解时会产生氨气和二氧化硫、三氧化硫等酸性气体,根据装置图可知,碱石灰可以吸收酸性气体,氨气遇到酚酞溶液会变红色,所以装置C 中可观察到的现象是溶液变红,由此可知莫尔盐晶体分解的产物中有 NH3.装置B的主要作用是吸收分解产生的酸性气体
考查方向
性质实验
解题思路
莫尔盐[(NH4)2Fe(SO4)2•6H2O]受热分解,分解时会产生氨气和二氧化硫、三氧化硫等酸性气体,根据装置图可知,碱石灰可以吸收酸性气体,氨气遇到酚酞溶液会变红色
易错点
摩尔盐的分解产物
教师点评
本题考查性质实验,明确各部分装置的作用是解答本题的关键,题目难度不大
下列实验过程中,始终无明显现象的是
正确答案
解析
略
知识点
化学无处不在,下列与化学有关的说法,不正确的是()
正确答案
解析
A对,侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,由于NaHCO3溶解度小于Na2CO3,故NaHCO3在溶液中析出。
B对,浓盐酸易挥发,与NH3结合生成NH4Cl固体小颗粒,为白烟。
C错,碘是人体必需元素,补碘常在食盐中加入KIO3固体而不是高碘酸,高碘酸为强酸性物质。
D对,制备黑火药的原料为S、KNO3、C,三者比例为1:2:3
知识点
硫酸镍铵[(NH4)xNiy(SO4)m·nH2O]可用于电镀、印刷等领域。某同学为测定硫酸镍铵的组成,进行如下实验:①准确称取2. 3350 g 样品,配制成100. 00 mL 溶液A;②准确量取25. 00 mL 溶液A,用0. 04000 mol·L-1 的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+ ),消耗EDTA 标准溶液31. 25 mL;③另取25. 00 mL溶液A,加足量的NaOH 溶液并充分加热,生成NH3 56. 00 mL(标准状况)。
(1)若滴定管在使用前未用EDTA 标准溶液润洗,测得的Ni2+含量将 (填“偏高”、或“偏低”或“不变”)。
(2)氨气常用 检验,现象是 。
(3)通过计算确定银硫酸镍铵的化学式(写出计算过程)。
正确答案
见解析。
解析
(1)偏高
(2)湿润的红色石蕊试纸 试纸颜色由红变蓝
(3)n(Ni2+)= 0. 04000 mol·L-1×31. 25 mL×10-3L·mL-1 =1. 250×10-3 mol
n(NH4 +)= =2. 500×10-3 mol
n(SO42-)= ==2. 500×10-3mol
m(Ni2+)= 59 g·mol-1×1. 250×10-3 mol=0. 07375 g
m(NH4+)= 18 g·mol-1×2. 500×10-3 mol=0. 04500 g
m(SO42-)= 96 g·mol-1×2. 500×10-3 mol=0. 2400 g
n(H2O)= 1. 250×10-2 mol
x :y :m:n= n(NH4+):n(Ni2+):n(SO42-):n(H2O)= 2:1:2:10
硫酸镍铵的化学式为(NH4)2Ni(SO4)2·10H2O
知识点
扫码查看完整答案与解析