- 常见无机物及其应用
- 共1311题
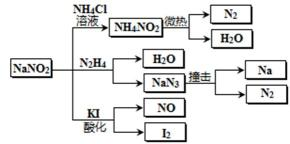
13. 亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,物理性质与NaCl极为相似。相关化学性质如下图所示,下列说法不正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
28. NO2压缩成N2O4可作火箭燃料中的氧化剂,也可制备硝化试剂N2O5等。
(1)火箭燃料燃烧反应如下:
2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)
若1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14 kJ的热量。则该反应的△H = ____________kJ·mol-1。
(2)在2 L密闭容器内,投入一定量NO2,发生下列反应:2NO2(g)
①不能说明该反应已达到平衡状态的是________________(填字母)。
a.v正(NO2)=2v逆(O2)
b.c(NO2)= c(NO)
c.气体总压不变
d.NO的体积分数保持不变
②下列说法正确的是______________(填字母)。
a.三个实验开始投入的NO2的物质的量均为1.0 mol
b.实验Ⅱ和实验Ⅰ相比,可能隐含的条件是:实验Ⅱ使用了效率更高的催化剂
c.该反应是放热反应
d.实验Ⅰ条件下反应的平衡常数大于实验Ⅲ条件下反应的平衡常数
e.800℃时,该反应的平衡常数为0.25
f.该反应的△S>0,故该反应一定是自发反应
③实验Ⅱ从反应开始到刚达到平衡时,v(O2)=( )mol·L-1·min-1;若再向该2 L密闭容器中通入1 mol NO2、1 mol NO、0.5 mol O2,则平衡将( )移动(填“向右”、“向左”或“不”)。
(3)利用NO2或N2O4可制备N2O5,原理如下图所示。N2O5在电解池的_____________
(填“阴极”或“阳极”)区生成,其电极反应式为( )。
正确答案
(1)-1224.96
(2)①b ②be ③0.0125 向左
(3)阳极 N2O4+2HNO3-2e-=2N2O5+2H+
解析
解析已在路上飞奔,马上就到!
知识点
卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。
查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O
② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O
④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应
(填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量 ,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
正确答案
见解析。
解析
(1)0.006 酸性
(2)② 不能 该反应只能说明I2的还原性比Br2强
(3)BrO3- > IO3- > Br2 > I2
BrO3- + 5Br- + 6H+ = 3Br2 + 3H2O
(4)
知识点
研制和开发不含碳并可工业生产的清洁能源,一直是科学家不懈追求的目标,目前液氨被人们视为一种潜在的清洁燃料。液氨燃烧的化学反应方程式为:4NH3 + 3O2→ 2N2 + 6H2O,和氢燃料相比有关数据见下表,据此判断正确的是
① 以氨和氢为燃料时,可以减缓温室效应
② 氨泄漏到空气中比氢气更易发生爆炸
③ 等质量的氨和氢分别燃烧,氢放出的热量多
④ 氮的液化比氢容易得多
正确答案
解析
以NH3和H2为燃料,反应的产物只有N2 和H2O,没有温室气体CO2产生,因此不会加剧温室效应;由题给有关数据可推知,NH3比H2易液化,也易贮存。
知识点
化学无处不在,下列与化学有关的说法,不正确的是()
正确答案
解析
A对,侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,由于NaHCO3溶解度小于Na2CO3,故NaHCO3在溶液中析出。
B对,浓盐酸易挥发,与NH3结合生成NH4Cl固体小颗粒,为白烟。
C错,碘是人体必需元素,补碘常在食盐中加入KIO3固体而不是高碘酸,高碘酸为强酸性物质。
D对,制备黑火药的原料为S、KNO3、C,三者比例为1:2:3
知识点
下列说法错误的是
正确答案
解析
略。
知识点
已知HCN是一种无色剧毒气体,遇皮肤或通过呼吸道吸入均会造成严重的中毒或死亡,HCN遇明火或强灯光均会易燃或易爆.它的水溶液是一种极弱的易挥发酸,结合以上信息,下列说法你论为错误的是
正确答案
解析
A:HCN具有还原性,漂白粉具有氧化性,加入足量石灰和漂白粉,可将HCN氧化为无毒物质,故A正确;B:由题给信息可知检查HCN外溢时,必须避免皮肤接触以及爆炸等事故,应穿特制防护服,并用特制的手电筒,故B正确;C:冶金废水不能直接排放,含有的HCN会严重污染水源,故C错误;D:在通风橱中进行,可防止中毒,故D正确。故选C。
知识点
8.下列关于自然界中氮循环(如右图)的说法不正确的是:( )
正确答案
解析

知识点
已知:将Cl2通人适量KOH溶液,产物中可能有



正确答案
解析
略
知识点
溴是中学化学一种重要的试剂,下列关于溴的说法正确的是 ( )
正确答案
解析
略
知识点
氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品及精制的流程:
已知:Br2是易挥发、深红棕色的液体;氢溴酸是易挥发、无色液体。
根据上述流程回答下列问题:
(1)反应室①中发生反应的化学方程式为 ___________ 。
(2)反应室①使用冰水的目的 ___________ 。
(3)操作I的名称___________,操作Ⅱ用到的玻璃仪器有___________ 。
(4)反应室②中加入Na2SO3的目的是___________。
(5)工业生产中制得的氢溴酸带有淡淡的黄色。于是甲乙两同学设计了实验加以探究:
①甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则用于证明该假设所用的试剂为___________ ,若假设成立可观察到的现象为___________。
②乙同学假设工业氢溴酸呈淡黄色是因为___________,其用于证明该假设成立的方法为 ___________ 。
正确答案
见解析。
解析
(1)SO2+Br2+2H2O=H2SO4+2HBr
(2)防止Br2和HBr挥发
(3)蒸馏,漏斗、玻璃棒、烧杯。
(4)还原粗品中的Br2
(5)①KSCN溶液,氢溴酸遇KSCN溶液变红色
②氢溴酸中含有Br2,用玻璃棒蘸取制得的氢溴酸,点在湿润淀粉KI试纸上变蓝(或用胶头滴管取制得的氢溴酸于试管中,滴加CCl4、振荡、静止,下层呈橙红色),证明因含Br2而显黄色。
知识点
用普通圆底烧瓶将某卤化钠和浓硫酸加热至500℃制备纯净HX气体,则该卤化钠是()
正确答案
解析
略
知识点
已知NaCN溶液呈碱性;(CN)2与卤素单质的性质相似;CN-的还原性介于Br-、I-之间。下列变化不能发生的是 ()
正确答案
解析
略
知识点
下列叙述中正确的是
正确答案
解析
略
知识点
下列微粒的存在最能说明碘可能呈现金属性的是()
正确答案
解析
略
知识点
扫码查看完整答案与解析