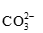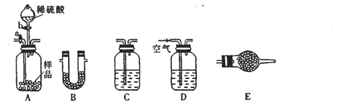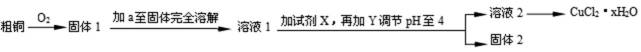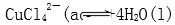- 常见无机物及其应用
- 共1311题
5.二氧化硫能使溴水褪色,说明二氧化硫具有( )
正确答案
解析
【解析】二氧化硫具有还原性,与溴水发生氧化还原反应生成氢溴酸和硫酸,使溴水褪色,硫元素化合价升高,体现还原性.故选A.
考查方向
解题思路
二氧化硫与溴水发生氧化还原反应生成氢溴酸和硫酸.
易错点
本题主要考查了二氧化硫的性质,侧重考查二氧化硫的还原性,注意中间价态的元素既有氧化性又有还原性,同种元素相邻价态间不发生氧化还原反应,题目难度不大.
知识点
7.下列实验设计正确的是
A.将SO2通入溴水中证明SO2具有漂白性
B.将铁屑放入稀HNO3中证明Fe比H2活泼
C.将澄清石灰水滴入某溶液证明其中存在
D.将乙烯通入KmnO4酸性溶液证明乙烯具有还原性
正确答案
D
知识点
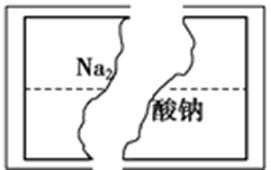
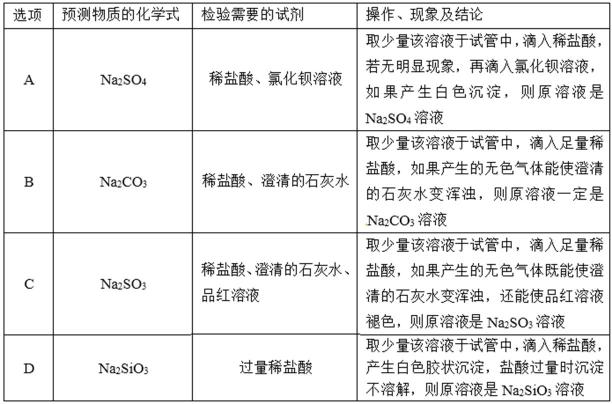
6.某研究性学习小组在整理实验室化学试剂时,发现一瓶盛有无色溶液的试剂,标签破损,如图。某同学根据中学化学知识,对该溶液中的溶质成分进行如下预测和验证,其中错误的是(包括预测物质的化学式、检验需要的试剂、操作、现象及结论) ()
正确答案
解析
A.取少量该溶液于试管中,滴入稀盐酸,盐酸可排除其它离子的干扰,若无明显现象,再滴入氯化钡溶液,如果产生白色沉淀,沉淀为硫酸钡,则原溶液是Na2SO4溶液,故A正确;
B.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体能使澄清的石灰水变浑浊,无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫,则溶液可能为Na2CO3溶液,故B错误;
C.取少量该溶液于试管中,滴入足量稀盐酸,如果产生的无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫,所以则原溶液是Na2SO3溶液,故C正确;
D.取少量该溶液于试管中,滴入稀盐酸,产生白色胶状沉淀,盐酸过量时沉淀不溶解,硅酸不溶于盐酸,则原溶液是Na2SiO3溶液,故D正确。
考查方向
解题思路
A.盐酸可排除其它离子的干扰,再滴加氯化钡产生白色沉淀,则沉淀为硫酸钡;
B.无色气体时澄清石灰水变浑浊,气体可能为二氧化碳,或二氧化硫;
C.无色气体既能使澄清的石灰水变浑浊,还能使品红溶液褪色,则气体为二氧化硫;
D.硅酸不溶于盐酸.
易错点
离子的检验及气体的检验。
知识点
28.某研究小组将纯净的SO2气体通入0.1mol·L-1的Ba(NO3)2溶液中,得到了BaSO4沉淀,为探究上述溶液中何种微粒能养护通入的SO2,该小组突出了如下假设:
假设一:溶液中的NO3-
假设二:溶液中溶解的O2
(1)验证假设
该小组涉及实验验证了假设一,请在下表空白处填写相关实验现象
(2) 为深入研究该反应,该小组还测得上述两个实验中溶液的pH随通入SO2体积的变化曲线入下图
实验1中溶液pH变小的原因是____;V1时,实验2中溶液pH小于实验1的原因是(用离子方程式表示)_________。
(3)验证假设二:
(4)验证假设二
请设计实验验证假设二,写出实验步骤,预期现象和结论。
(5)若假设二成立,请预测:在相同条件下,分别欧诺个足量的O2和KNO3,氧化相同的H2SO3溶液(溶液体积变化忽略不计),充分反映后两溶液的pH前者_______(填大于或小于)后者,理由是___________。
正确答案
(1)无明显现象 有白色沉淀生成
(2)

(或
(3)
(4)小于 反应的离子方程式表明,足量的



解析
解析已在路上飞奔,马上就到!
知识点
5.有关物质性质的比较,错误的是
正确答案
解析
A.生铁是合金,熔点小于纯铁的熔点,故熔点为纯铁>生铁,故A正确;
B.水的密度等于1g/ml,硝基苯的密度大于1g/ml,所以密度:水<硝基苯,故B正确;
C.碳酸氢钠不稳定受热分解生成碳酸钠,所以热稳定性:NaHCO3<Na2CO3,故C正确;
D.苯中碳碳键介于单键和双键之间,碳碳键键长:乙烯<苯,故D错误
考查方向
物质性质的递变规律
解题思路
A.生铁是合金,合金的熔点一般小于各组分的熔点;
B.水的密度等于1g/ml,硝基苯的密度大于1g/ml;
C.碳酸氢钠不稳定受热分解生成碳酸钠;
D.苯中碳碳键介于单键和双键之间
易错点
A项,合金的熔点低于组分的熔点
教师点评
本题考查物质性质的递变规律,侧重于熔点、热稳定性、密度等性质的考查,题目难度不大,注意把握性质比较的角度以及规律
知识点
有关下列物质说法正确的是( )
正确答案
解析
略
知识点
光谱研究表明,易溶于水的S02所形成的溶液中存在着下列平衡:
据此,下列判断中正确的是
正确答案
解析
本题主要考察化学平衡状态的特点和外界条件对化学平衡对影响。因为该反应是可逆反应,所以达到平衡后反应物和生成物共同存在与体系中,所以选项A正确;溶液中H+的来源有3个方面,即水的电离、SO2·xH2O和HSO3-的电离,因此溶液中H+浓度不一定是SO32-浓度的2倍,选项B错误;SO2是一种还原性气体,若加入的酸是氧化性酸,SO2将被氧化成硫酸而不会放出SO2气体,选项C错误;NaHSO3是一种酸式盐可以与NaOH反应,方程式为NaHSO3+NaOH=Na2SO3+H2O,选项D也错误。
知识点
甲醛与亚硫酸氢钠的反应方程式为HCHO+NaHSO3
正确答案
解析
从化学组成上讲吊白块相当于钠盐,易溶于水,由于生产吊白块的反应为可逆反应,因此吊白块使用时会释放出甲醛,因此不能用于食品加工,由于甲醛可使蛋白质变性,具有防腐作用,故工业上常用作防腐剂。
知识点
化学源于生活又用于生活,下列有关应用不正确的是
正确答案
解析
试题分析:A,乙烯是植物生长调节剂,高锰酸钾能把乙烯氧化为二氧化碳,从而可以降低乙烯的含量。故用浸泡高锰酸钾溶液的硅土来吸收水果或花朵产生的乙烯以达到保鲜效果。正确。B,我们日常生活经常食用的淀粉、蛋白质都是天然高分子化合物,而豆油是高级脂肪酸的甘油酯,不是高分子化合物。错误。C,船身上附装金属Zn,Fe、Zn及海水就构成了原电池。由于Zn的活动性比Fe强,作原电池的负极,发生氧化反应。Fe就得到了保护。因此是利用了Zn的金属活泼性。正确。D,含硫化石燃料在燃烧时会产生大量的SO2,SO2与空气中的水发生反应产生亚硫酸,进而被空气中的氧气氧化为硫酸导致酸雨。故大量燃烧是酸雨形成的主要原因之一。正确。
知识点
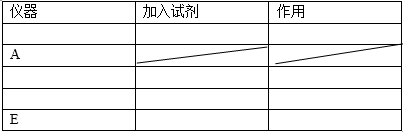
29.完成对硫代硫酸钠(
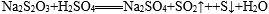
(1)请填写下表(按仪器连接顺序由上到下依次填入,各仪器只能使用一次)。可供选用的试剂有品红溶液、NaOH溶液、浓硫酸、无水硫酸铜、碱石灰。
(2)若实验中称取m1g混合物样品进行实验。
①组装好上述仪器后,应首先进行的实验操作是( ),
②若实验前后装置C的质量分别为m2g、m3g,装置B的质量分别为m4g、m5g,则样品中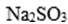
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
氯化铜用作陶瓷着色剂、玻璃、电镀添加剂、催化剂、照相制版及饲料添加剂等。某学习小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
已知氯化铜易溶于水,难溶于乙醇。
13.溶液1中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液1中Fe2+的试剂 (填编号)
①KMnO4
②K3[Fe(CN)6]
③NaOH
④KSCN
为了更完全的沉淀,试剂X为 。
14.试剂a是 ,加入需过量的原因是 。试剂Y用于调节pH以除去杂质,Y可选用下列试剂中的 (填序号)。
a.NaOH
b.NH3·H2O
c.CuO
d.Cu2(OH) 2CO3
e.CuSO4
调节pH至4的原因是 。
得到固体2的操作是 。
15.在溶液2转化为CuCl2·xH2O的操作过程中,发现溶液颜色由蓝色变为绿色。欲探究其原因。已知:在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。若增大氯离子浓度,K值 (填“增大”、“减小”或“不变”)
16.② 取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是 (填序号)。
a.将Y稀释,发现溶液呈蓝色
b.在Y中加入CuCl2晶体,溶液变为绿色
c.在Y中加入NaCl固体,溶液变为绿色
d.取Y进行电解,溶液颜色最终消失
17.得到CuCl2·xH2O晶体最好采用的干燥方式是 。
18.为测定制得的氯化铜晶体(CuCl2·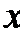
正确答案
② H2O2溶液
解析
由图示可知:粗铜和氧气反应生成氧化铜、四氧化三铁,加入稀盐酸至固体完全溶解,为了防止氯化铜等物质发生水解,加入过量稀盐酸得溶液1,再加入过氧化氢溶液将部分可能存在的亚铁离子氧化成三价铁离子,再加入碱式碳酸铜调节溶液的酸碱度至pH在4,使三价铁离子生成氢氧化铁除去,过滤可得固体2氢氧化铁和溶液2氯化铜溶液,蒸发结晶得氯化铜晶体(CuCl2·2H2O)。
铁氰酸钾(铁氰化钾),不和Fe3+、Cu2+反应,和Fe2+反应得到一种蓝色的沉淀,溶液1中的金属离子有Fe3+、Fe2+、Cu2+,能检验溶液1中Fe2+的试剂是②K3[Fe(CN)6],故选②;
为了更完全的沉淀,将铁离子和亚铁离子完全除去,应先将亚铁离子氧化成铁离子,同时又不带入杂质离子,试剂X为H2O2溶液;
考查方向
解题思路
由图示可知:粗铜和氧气反应生成氧化铜、四氧化三铁,加入稀盐酸至固体完全溶解,为了防止氯化铜等物质发生水解,加入过量稀盐酸得溶液1,再加入过氧化氢溶液将部分可能存在的亚铁离子氧化成三价铁离子,再加入碱式碳酸铜调节溶液的酸碱度至pH在4,使三价铁离子生成氢氧化铁除去,过滤可得固体2氢氧化铁和溶液2氯化铜溶液,蒸发结晶得氯化铜晶体(CuCl2·2H2O)。
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
稀盐酸 盐酸充分反应,且能抑制Cu2+水解 cd;
为了使Fe3+完全沉淀而Cu2+不沉淀,可以调节pH至4 过滤
解析
将氧化铜、四氧化三铁溶解,应加入稀盐酸至固体完全溶解,试剂a是稀盐酸,加入需过量的原因是盐酸充分反应,且能抑制Cu2+水解。试剂Y用于调节pH以除去杂质铁离子,应该可以将酸碱度升高,而且不会带入杂质离子,Y可选用CuO 或Cu2(OH) 2CO3,故选cd;
因为pH=3时,Fe3+完全沉淀而Cu2+不沉淀,为了使Fe3+完全沉淀而Cu2+不沉淀,可以调节pH至4;
利用过滤将固液混合物分离,得到固体2和溶液2;
考查方向
解题思路
(2) 将氧化铜、四氧化三铁溶解,应加入稀盐酸至固体完全溶解,加入需过量的原因是盐酸充分反应,且能抑制Cu2+水解。调节pH以除去杂质铁离子,应该可以将酸碱度升高,而且不会带入杂质离子,可选用CuO 或Cu2(OH) 2CO3;pH=3时,Fe3+完全沉淀而Cu2+不沉淀;
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
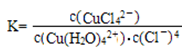
解析
在溶液2转化为CuCl2·xH2O的操作过程中,发现溶液颜色由蓝色变为绿色。在氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq)+4Cl-(aq) CuCl42-(aq)
蓝色 黄色
上述反应的化学平衡常数表达式是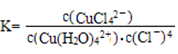
考查方向
制备实验方案的设计
解题思路
化学平衡常数表达式是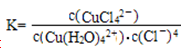
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
abc
解析
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是:
a.将Y稀释,平衡向逆反应方向移动,溶液呈蓝色,正确;
b.在Y中加入CuCl2晶体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色,正确;
c.在Y中加入NaCl固体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色,正确;
d.取Y进行电解,氯离子失去电子,生成氯气,铜离子得到电子,生成金属铜,溶液颜色最终消失,与平衡移动无关,错误;
故选abc;
考查方向
解题思路
取氯化铜晶体配制成蓝绿色溶液Y,进行如下实验,其中能够证明CuCl2溶液中有上述转化关系的是:
a.将Y稀释,平衡向逆反应方向移动,溶液呈蓝色;
b.在Y中加入CuCl2晶体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色;
c.在Y中加入NaCl固体,氯离子浓度增大,平衡向正反应方向移动,溶液变为绿色;
d.取Y进行电解,氯离子失去电子,生成氯气,铜离子得到电子,生成金属铜,溶液颜色最终消失,与平衡移动无关;
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案
解析
CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干,故选D。
考查方向
解题思路
CuCl2•xH2O晶体加热容易分解,且氯化铜易水解,应在HCl气流中低温烘干。
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
正确答案

解析
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒:n(CuCl2•xH2O)=n(CuO)=
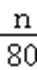

考查方向
解题思路
氢氧化铜加热分解所得黑色固体的质量ng为CuO,根据Cu元素守恒计算;
易错点
本题是一道制备实验方案的设计题,考查学生金属铜以及化合物的性质知识,综合性强,难度大。
9.碳酸镍可用于电镀、陶瓷器着色等。镍矿渣中镍元素的主要存在形式是Ni(OH)2和NiS(含有Fe、Cu、Ca、Mg、Zn等元素杂质),从镍矿渣出发制备碳酸镍的流程如下:
已知:常温下,溶度积常数

②NiS + ClO3- + H+ — Ni2+ + S + Cl- + H2O(未配平),此反应中还原产物与氧化产物的物质的量比为____________。
(2)经实验检验,含Ni2+浸出液中铁元素的存在形式只有Fe3+,证明该溶液中无Fe2+可选用的试剂是____________________,现象为______________________________。
(3)加入Na2CO3溶液沉铁时生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6]和一种无色气体。写出此反应的离子方程式:__________________________________________________。
(4)加入NiS的作用是除去溶液中的Cu2+,原理是NiS(s) + Cu2+(aq)
(5)加入NaF的作用是______________________________。
(6)加入Na2CO3溶液沉镍,检验Ni2+是否沉淀完全的方法是____________________。
正确答案
(1)Ni(OH)2 + 2H+ = Ni2+ + 2H2O 1:3
(2)少量KMnO4溶液或K3[Fe(CN)6]溶液);KMnO4溶液紫色未褪或未产生蓝色沉淀
(3)Na+ + 3Fe3+ + 2SO42–+ 3H2O + 3CO32– = NaFe3(SO4)2(OH)6 ↓+ 3CO2↑
(4)1.27×10–16
(5)除去溶液中的Ca2+、Mg2+
(6)静置后取上层清液少许于试管中,滴加Na2CO3溶液,若未出现浑浊,则沉淀完全
解析
(1)由于镍矿渣中镍元素的存在形式Ni(OH)2,所以发生反应的离子方程式为:Ni(OH)2 + 2H+ = Ni2+ + 2H2O,由于还原产物Cl-化合价降低了6,氧化产物S的化合价升高了2,所以根据化合价的公倍数确定物质的量比为2:6=1:3;
(2)要证明Fe3+溶液中无Fe2+,可选用少量酸性KMnO4溶液,Fe2+可使酸性KMnO4溶液褪色,或可选用K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]溶液反应有蓝色沉淀产生;
(3)Na2CO3溶液沉铁时生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6]和一种无色气体,根据元素守恒可知气体为CO2,所以发生反应的离子方程式为:Na+ + 3Fe3++ 2SO42–+ 3H2O + 3CO32–= NaFe3(SO4)2(OH)6 ↓+ 3CO2↑
(4)根据反应NiS(s) + Cu2+(aq)CuS(s) + Ni2+(aq)可知,
K=Ksp(NiS)/Ksp(CuS)=c(Ni2+) /c(Cu2+)=(1.07 × 10-21)/(1.27 × 10-36)=1.27×10–16
(5)由于滤液3中无Ca2+、Mg2+离子,所以根据元素守恒可知加入NaF的作用是除去溶液中的Ca2+、Mg2+;
(6)由于NiCO3溶液为沉淀,所以用Na2CO3溶液检验Ni2+是否沉淀,即静置后取上层清液少许于试管中,滴加Na2CO3溶液,若未出现浑浊,则沉淀完全。
考查方向
解题思路
(1)根据镍矿渣中镍元素的存在形式Ni(OH)2进行分析,完成方程式,还原产物与氧化产物的物质的量比可以根据化合价的公倍数确定;
(2)证明Fe3+溶液中无Fe2+可选用的试剂少量KMnO4溶液(褪色)或K3[Fe(CN)6]溶液(蓝色沉淀)
(3)Na2CO3溶液沉铁时生成难溶于水的黄钠铁矾[NaFe3(SO4)2(OH)6]和一种无色气体,根据元素守恒可知气体为CO2
(4)根据反应NiS(s) + Cu2+(aq)
(5)根据元素守恒可知滤液3中无Ca2+、Mg2+离子,所以加入NaF的作用是除去溶液中的Ca2+、Mg2+;
(6)由于NiCO3溶液为沉淀,所以用Na2CO3溶液检验Ni2+是否沉淀。
易错点
不能有效提取图表中信息,阅读材料、接受信息的能力不强,物质的分离提纯的方法掌握不熟练,不能通过化合价升价确立生成物的比值,不能根据原子守恒确立反应方程式以及分析物质的作用。
知识点
合金是建造航空母舰的主体材料。如:航母舰体可由合金钢制造,航母升降机可由铝合金制造;航母螺旋桨主要用铜合金制造。
(1)Al原子核外电子占据 个纺锤形轨道;Fe原子核外电子排布式为
(2)下列事实可用作比较Al和Fe金属性强弱依据的是 ( )
A,Al的导电性、导热性比Fe更好
B,

C,相同质量的Al片和Fe片,投入到等浓度的稀硫酸溶液中,Al片产生氢气更多
D,在野外利用铝热剂焊接铁轨
(3),航母在海洋中行驶时,舰体发生的电化学腐蚀类型为: ,其中正极发生的电极反应式为: 。
(4)取a克CuAl合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,则合金中Cu的质量分数为 。
(5)AlMg合金焊接前用NaOH溶液处理铝表面Al2O3膜,其化学方程式为: 。
(6)取适量AlMg合金样品置于烧杯中,加入20mL 1 mol/L的NaOH溶液,恰好完全反应。
下列叙述正确的是 ( )
A,Mg作负极,Al作正极
B,该反应速率比纯铝与NaOH溶液的反应速率快
C,若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为
D,若加入的是20mL 1 mol/L的盐酸,则放出的氢气的物质的量减少
正确答案
(1) 4 , 7种
(2)D
(3)吸氧腐蚀 , O2 +2H2O+4e →4OH―
(4)0.80
(5) Al2O3 + 2NaOH → 2NaAlO2 +H2O
(6)BD
解析
略
知识点
将铜丝烧热,迅速插入氢气中,发生反应:
正确答案
解析
略
知识点
有4种金属a、b、c、d,它们与浓HNO3反应时,只有a不反应;往这4种金属粉末的混合物中加入盐酸,其中b、c溶解,过滤后,在滤液中加入过量的NaOH溶液,可得到c离子的沉淀,则这4种金属的活动性强弱的顺序可能是
正确答案
解析
略
知识点
扫码查看完整答案与解析