- 常见无机物及其应用
- 共1311题
3.关于相同物质的量浓度的NaHCO3溶液和Na2CO3溶液,下列说法不正确的是( )
正确答案
解析
A.NaHCO3通过水解生成H2CO3,同时还有OH-,通过电离可以生成 CO32-,Na2CO3通过两步水解生成HCO3- 及H2CO3,同时还有OH,所以Na2CO3和NaHCO3溶液均含有阳离子Na+、H+和阴离子OH-、HCO3-、CO32-及H2CO3 分子,所以A 正确;
B.Na2CO3和NaHCO3溶液均水解呈碱性,但是Na2CO3通过两步水解,溶液中c(OH-) ,所以pH大,所以B 错误;
C.Na2CO3和NaHCO3溶液均可以与HCl反应生成CO2,所以C 正确;
D.碳酸钠可以和氢氧化钙之间反应生成碳酸钙沉淀和氢氧化钠,碳酸氢钠也可以和氢氧化钙之间反应生成碳酸钙沉淀,所以D 正确;
考查方向
通过相同物质的量浓度的NaHCO3溶液和Na2CO3溶液中离子种类、溶液的pH以及与与盐酸、澄清石灰水的反应,考查盐类的水解以及碳酸盐的化学性质。
解题思路
A.NaHCO3通过水解生成H2CO3 ,同时还有OH-,通过电离可以生成 CO32-,Na2CO3通过两步水解生成HCO3- 及H2CO3,同时还有OH-;
B.Na2CO3和NaHCO3溶液均水解呈碱性,但是Na2CO3通过两步水解,溶液中c(OH-) ,所以pH大;
C.Na2CO3和NaHCO3溶液均可以与HCl反应生成CO2;
D.Na2CO3可以和氢氧化钙之间反应生成碳酸钙沉淀和氢氧化钠,NaHCO3中的HCO3-先与氢氧化钙中的OH-反应生成CO32-,CO32-再与Ca2+反应生成碳酸钙沉淀,所以也可以和碳酸氢钠也可以和氢氧化钙之间反应生成碳酸钙沉淀。
易错点
NaHCO3和Na2CO3溶液的组成虽然不同,但是在水溶液中的离子种类相同,且均可与澄清石灰水反应生成碳酸钙沉淀而变浑浊。
知识点
20.已知NaOH+Al(OH)3→Na[Al(OH)4]。向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是( )
A. CO2+2OH−→CO32−+H2O
B.Al2O3+2OH−+3H2O→2 [Al(OH)4]−
C. 2 Al+2OH−+6H2O→2[Al(OH)4]−+3 H2↑
D. Al3++4 OH−→[Al(OH)4]−
正确答案
知识点
3.0.1mol下列气体分别与1L 0.l mol·L-1的NaOH溶液反应,形成的溶液pH最小的是
正确答案
解析
A.NO2与NaOH恰好完全反应: 2NO2+2NaOH=NaNO2+NaNO3+H2O,常温下生成的NaNO2水解而显碱性,pH>7; B.SO2 与NaOH恰好完全反应:SO2 +NaOH=NaHSO3,常温下生成的NaHSO3电离强于水解而显酸性,pH<7; C.SO3 与NaOH恰好完全反应:SO3 +NaOH=NaHSO4,常温下生成的NaHSO4电离强于水解、且比NaHSO3的电离程度更大,故酸性更强,pH更小——在四个选项中最小; D.CO2与NaOH恰好完全反应:CO2+NaOH= NaHCO3,常温下生成的NaHCO3水解强于电离而显碱性,pH>7。
考查方向
解题思路
通过这些非金属氧化物或酸性氧化物与碱的1:1的反应结果判断。
易错点
对二氧化氮与NaOH的反应不熟悉,以及NaHSO3电离强于水解而显酸性。
知识点
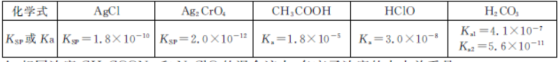
6.下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是 ( )[来源:学。科。网Z。X。X。K]
正确答案
解析
A.次氯酸根离子的水解程度大于醋酸根离子,所以c(CH3COO-)>c(ClO-),故A错误;B.HClO的电离平衡常数大于HCO3-,所以次氯酸的酸性大于碳酸氢根离子,则碳酸钠和少量氯水反应的离子方程式为:CO32-+Cl2+H2O═HCO3-+Cl-+H++ClO-,故B正确;C.缓冲溶液中pH=pKa+lg[(弱酸盐)/(弱酸)=4.8+lg(5/9)≈4.5,故C错误D.混合溶液中生成氯化银需要的c(Ag+)=[Ksp(AgCl)]/c(Cl-)=1.8×10-7mol/L,生成Ag2CrO4需要的c(Ag+)=[Ksp(AgCl)/c(Cl-)]1/2=4.47×10-5mol/L,所以氯离子先生成沉淀,故D错误;
考查方向
解题思路
A.次氯酸根离子的水解程度大于醋酸根离子,所以c(CH3COO-)>c(ClO-);B.弱电解质的电离平衡常数越大,其酸性越强,所以次氯酸比碳酸氢根离子的酸性强;C.混合溶液中pH=pKa+lg[(弱酸盐)/(弱酸) D.混合溶液中生成氯化银需要的c(Ag+)=[Ksp(AgCl)]/c(Cl-),生成Ag2CrO4需要的c(Ag+)=[Ksp(AgCl)/c(Cl-)]1/2;
易错点
A.不理解Ka越大,则酸性越强,对应的酸根离子水解程度越小,离子浓度越大;B.不能正确判断强弱酸的反应关系;C.不能熟练进行pH计算;D.不能准确判断Ksp与离子先后沉淀的关系。
知识点
19.常温下,用0.1000 mol•L-1 NaOH溶液滴定20.00mL0.1000 mol•L-1 CH3COOH溶液所得滴定曲线如右图,下列说法不正确的是
正确答案
解析
A.在点③时, NaOH溶液和CH3COOH溶液的等体积、等浓度混合,溶液中含有的物质的量相等,等物质的量的醋酸和氢氧化钠恰好反应生成强碱弱酸盐醋酸钠,弱酸根醋酸根离子水解导致其溶液呈碱性;CH3COO-+H2O
考查方向
解题思路
A.点③时, NaOH溶液和CH3COOH溶液的体积均为20mL,而且浓度也相等,所以溶液中含有的物质的量也就相等,等物质的量的醋酸和氢氧化钠恰好反应生成醋酸钠,醋酸钠是强碱弱酸盐,弱酸根离子水解导致其溶液呈碱性;B.点②时溶液的pH=7,根据电荷守恒:c(CH3COO-)+c(OH-)=c(Na+)+c(H+),由于c(OH-)=c(H+),所以溶液中c(Na+)=c(CH3COO-)。C.点①溶液中NaOH溶液不足,反应后剩余的CH3COOH的物质的量为0.001mol,反应生成的CH3COONa也为0.001mol,此时溶液呈酸性,c(CH3COOH)>c(Na+),c(CH3COOH)+c(H+)>c(CH3COO-)+c(OH-)D.酸或碱对水的电离产生抑制作用,而能水解的盐对水的电离产生促进作用,在逐滴加入NaOH溶液的过程中,CH3COOH逐渐被NaOH中和,所以对水的电离的抑制程度减弱,当NaOH过量后,水的电离程度又逐渐减小。
易错点
不能准确提取图中信息,不会利用电荷守恒解决等量和大小关系。
知识点
1.下列物质直接参与的反应与氧化还原反应无关的是
正确答案
解析
A.维生素C具有还原性,可以防止二价铁元素被氧化,用作贫血患者补铁剂的搭档,错误;
B.二氧化硫与生石灰结合生成亚硫酸钙,与氧化还原反应无关,正确;
C.三价铁离子有氧化性,可与金属铜反应,氯化铁溶液可用于腐蚀印刷电路板,错误;
D.高铁酸盐中铁元素化合价为+6价,具有强氧化性,所以可用于杀菌、消毒,错误;故选B。
考查方向
解题思路
A.维生素C具有还原性,可以防止二价铁元素被氧化;
B.二氧化硫与生石灰结合生成亚硫酸钙,与氧化还原反应无关;
C.三价铁离子有氧化性,可与金属铜反应;
D.高铁酸盐中铁元素化合价为+6价,具有强氧化性;
易错点
高铁酸盐中铁元素化合价为+6价,具有强氧化性;
知识点
20.对有关NaClO和NaCl混合溶液的叙述正确的是
正确答案
解析
A.该溶液中,H++ClO–=HClO,不可以大量共存,A.错误;
B. S2–易被ClO–氧化而不能大量共存,故B正确;
C.滴入少量FeSO4溶液,离子方程式为:2Fe2++ClO–+H2O+4OH-→Cl–+2Fe(OH)3↓,故C.错误;
D.向该溶液中加入浓盐酸,发生ClO–与Cl–归中反应产生Cl2,有每产生1molCl2,转移电子约为6.02×1023个,是正确选项。
考查方向
解题思路
离子反应的条件及氧化还原反应。
易错点
忽视弱电解质HClO而错选A。
知识点
22.有两份组成及质量都相等的Na2O2和Na2CO3的混合物,向第一份中加入足量的稀硫酸,放出的气体共4.48 L。将此气体通入第二份混合物,充分反应后,气体体积变为4.032 L(均为标准状况下体积)。则原混合物中Na2O2和Na2CO3的物质的量之比为
正确答案
解析
依据“共4.48 L。将此气体通入第二份混合物,充分反应后,气体体积变为4.032 L(均为标准状况下体积)”可知: 2Na2O2+2CO2=2 Na2CO3+O2 △V 2 mol 2 mol 1 mol 22.4 L①Na2O2过量时: 0.04 mol 4.48 L-4.032 L=0.448 L 选D.②Na2O2不足时: 0.04 mol 4.48 L-4.032 L=0.448 L 选A.
考查方向
解题思路
依据方程式2Na2O2+2H2O=4NaOH+O2↑、Na2CO3+H2SO4=Na2SO4+CO2↑+H2O、
2Na2O2+2CO2=2 Na2CO3+O2。
易错点
忽视Na2O2的过量与不足而漏选。
知识点
11.向0.1 mol / L CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起
正确答案
解析
CH3COOH电离平衡中,加CH3COONa晶体,会抑制醋酸的电离(故B错误),c(H+)减小,c(OH-)增大(故D.错误)pH增大;且CH3COONa是强电解质,溶液中自由离子的浓度增大,导电能力增强(故C.错误);或加水稀释,促进醋酸的电离,但是溶液中c(H+)减小,则c(OH-)增大,pH增大,故A.正确。
考查方向
解题思路
CH3COOH电离平衡的移动原理。
易错点
B.CH3COOH的电离程度增大。
知识点
8.下列离子方程式中,正确的是
正确答案
解析
A.Na2O2是氧化物,在离子方程式中用化学式表示,即2Na2O2+2H2O=4OH-+O2↑,A错误;
B.次氯酸钙溶液中通入过量的CO2,生成碳酸钙和次氯酸,离子方程式为:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO,B正确;
C.碳酸氢钙溶液中滴入少量的NaOH溶液生成碳酸钙、碳酸钠和水,离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,C错误;
D.硝酸铝溶液中加入过量氨水生成氢氧化铝,离子方程式为:Al3++3NH4OH=Al(OH)3↓+3NH4+,D错误。
故选B。
考查方向
解题思路
A.Na2O2是氧化物,在离子方程式中用化学式表示;
B.次氯酸钙溶液中通入过量的CO2,生成碳酸钙和次氯酸;
C.碳酸氢钙溶液中滴入少量的NaOH溶液生成碳酸钙、碳酸钠和水;
D.硝酸铝溶液中加入过量氨水生成氢氧化铝。
易错点
解题注意碳酸氢钙溶液中滴入少量的NaOH溶液生成碳酸钙、碳酸钠和水。
知识点
3.下列叙述正确的是( )
正确答案
解析
加入澄清石灰石会同时和碳酸氢钠和碳酸钠反应,A项错误;
新制氯水既有酸性又有漂白性,故向其中滴加紫色石蕊试液,溶液先变红后褪色,B项错误;
醋酸钠溶液显碱性,对于碱性溶液来说,稀释后其他离子浓度降低,但是氢离子浓度增大,C项错误;
工业上利用电解熔融的氧化铝来制备金属铝,D项正确。
考查方向
解题思路
把握住题目中隐含的细节知识点考查,正确分析常见物质的离子在水溶液中的反应即可。
易错点
1、本题容易忽视氯水漂白性的分析 。
2、本题不容易理解碱性溶液稀释后,氢离子浓度增大,导致题目无法分析。
知识点
4.科学家设想以N2和H2为
正确答案
解析
题中所示原电池电解质为溶有A的稀盐酸,由题图可知反应过程中A的浓度增大,故A中含氮元素,结合题意可知是氯化铵;氢气还原性较强,参与负极反应,故电极反应为H2-2e-=2H+;氮气氧化性较强,参与正极反应,结合电解质溶液是稀盐酸和氯化铵的混合液,故正极电极反应式为N2+6e-+8H+=2NH4+,且电池外电路电流从通入N2的电极流向通入H2的电极。电池总反应方程式为:N2+3H2+2HCl=2NH4Cl,故反应过程中盐酸浓度降低,溶液pH变大,需要补充盐酸。总上述,本题答案选择C项。
考查方向
解题思路
先分析原电池的正负极及电解质,再分析电子流向和书写电极反应式。
易错点
本题易在原电池正负极的电极反应式书写及电子流向分析上出现错误 。
知识点
11.下列符合实际并用于工业生产的是
正确答案
解析
A.电解法冶炼金属是电解池原理,通常采用电解融融状态下的盐类物质,因为盐为离子化合物,在融融状态可以导电,但是氯化铝是一种共价化合物,熔融状态时不能导电,因此错误。
B.工业生产漂白粉的原理是氯气与氢氧化钙反应,澄清石灰水的浓度较低,吸收氯气的能力较弱,产量极低,因此通常采用石灰乳与氯气反应制备生产漂白粉。
C.工业上采用侯氏制碱法来生产纯碱,在饱和的碳酸钠溶液中通入过量的二氧化碳能生成溶解度较小的碳酸氢钠,但这导致原料的利用率大大降低,而采用侯氏制碱法能大大提高产率,更经济更实用。
D.工业生产的硫酸的主要步骤硫磺为原料,经燃烧、催化氧化、最后用98.3%浓硫酸吸收形成发烟硫酸,故正确。
考查方向
解题思路
根据具体的产物性质,依据制备原理以及化学知识加以验证
易错点
对常见物质的工业制法理解认知缺乏
知识点
16. 7.8克过氧化钠固体在常温低压下,与一定量的水蒸气反应,最终得到固体16.8克,此固体物质中一定含有
正确答案
解析
7.8克过氧化钠就是0.1mol 了,而最终得到的固体的质量是16.8克,根据反应的元素可知,得到的固体必有Na ,得到的的物质的分子质量大于168的就只有D,而反应定是没有进行完,如果进行完的话上面的物质的分子量没有一个符合,故选D
考查方向
解题思路
元素守恒法,钠的化合物相关性质
易错点
化学计算常用方法
知识点
7.下列离子方程式中,正确的是
正确答案
解析
A.钠放入水中
C.实验室用氯化铝溶液和氨水制氢氧化铝 NH3.H2O 不能拆
D.向碳酸氢铵溶液中加入足量氢氧化钠溶液
考查方向
解题思路
熟练元素化合物知识,从守恒角度进行检查
易错点
方程式中的守恒关系易错,反应原理易错
知识点
扫码查看完整答案与解析