- 根据化学式判断化合价
- 共17题
6.己知在碱性溶液中可发生如下反应:
2R(OH)3 + 3C1O- + 4OH- = 2RO4n-+3Cl- +5H2O。则RO4n-中R的化合价是
正确答案
解析
依据:因为3C1O- →3Cl-↓3×2=6;设R升高化合价为x,则2R(OH)3→2RO4n-↑2x=6 ,x=3,即RO4n-中的R为+6价,且n=2,故选D。或依据电荷守恒可得:方程式左边电荷的代数和为-3+(-4)= -7,则方程式右边:-2n+(-3)= - 7,n=2,故RO4n-中的R为+6价。
考查方向
解题思路
依据化合价升降总数相等。或电荷守恒。
易错点
混淆化合价的升降数与氧化产物中R的化合价。
知识点
29.锌是一种应用广泛的金属,火法炼锌是将闪锌矿(主要含ZnS)焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1100—1300℃,使锌蒸馏出来(设空气中N2、O2的体积分数分别为0.8、0.2)。主要反应为:
焙烧炉中:2ZnS(s)+3 O2
鼓风炉中:2C(s)+ O2 (g) 
鼓风炉中:ZnO(s)+CO(g) 
(1)ZnS质量分数为0.620的闪锌矿(杂质不含锌)中锌的质量分数为_______ (保留三位小数)。
(2)焙烧炉产生的炉气中SO2的体积分数不超过_______ (保留三位小数)。
(3)鼓风炉容积固定,炉内部分气态物质物质的量浓度(mol/L)变化如下:
则鼓风炉中CO的总转化率为___________;若生产中CO的总利用率为98%,则每生产1 mol Zn至少需补充焦炭_________g。
(4)若ZnS全部转化为Zn。焙烧炉出来的N2、O2、SO2的混合气体中N2占82.5%,鼓风炉中CO的转化率为62.5%,而O2无剩余。则每生产1molZn,应向焙烧炉和鼓风炉中鼓入新鲜空气共为多少L(STP)?
正确答案
(1)0.415
(2)0.143
(3)90.9%;12.25g
(4)459.2L
解析
解析已在路上飞奔,马上就到!
知识点
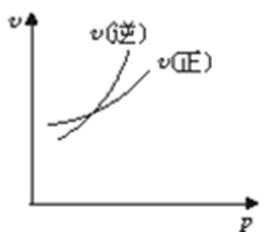
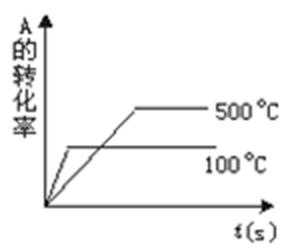
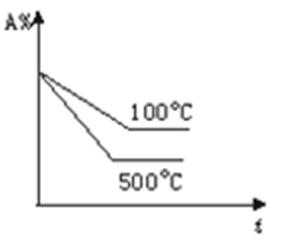
14.对于可逆反应A(g)+2B(g)
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
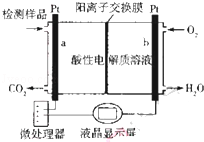
8.甲醇(CH3OH)是一种有毒物质,检测甲醇含量的测试仪工作原理示意图如下.下列说法正确的是( )
正确答案
解析
解析已在路上飞奔,马上就到!
知识点
27.有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:
① Cu2O + 2H+ = Cu + Cu2+ + H2O;
② 部分氢氧化物在溶液中沉淀的pH见下表:
注:金属离子的起始浓度为0.1 mol·L-1
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为______________________________。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是__________。
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是__________;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是___________________________。
(4)Ⅳ中加NaClO的目的是______________________________。
(5)将Ⅳ中得到的溶液D电解,阳极的电极反应式为______________;若电路中有0.1mol电子通过,则理论上阴极质量增重____________g。
(6)由上述实验可以获得结论:原样品所有可能的成分组合为
组合1:__________________;
组合2:__________________;(用化学式表示)
正确答案
(1)2Al+2OH-+2H2O = 2AlO2-+3H2↑
(2)SiO2
(3)Fe2+;向待测液中滴加K3[Fe(CN)6]溶液,出现蓝色沉淀(或向酸性KMnO4溶液中滴加待测液,褪色。此处不能选KSCN和氯水,因为不确定溶液中是否存在Fe3+)
(4)将Fe2+氧化成Fe3+,增大溶液的pH使Fe3+生成Fe(OH)3沉淀。
(5)2Cl-- 2e- = Cl2↑; 3.2
(6)
组合1:Al、Fe2O3、Cu2O;
组合2:Al、Cu2O、Fe3O4;
组合3:Al、Fe2O3、Cu2O、Fe3O4。
解析
解析已在路上飞奔,马上就到!
知识点
22.黄铁矿石的主要成分为FeS2(含少量FeS,假设其他杂质中不含Fe、S元素,且高温下不发生化学变化),是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对该黄铁矿石进行如下实验探究。
将
【实验一】测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:
(1)甲装置的作用是___________________;鼓入空气的作用是______________________。
(2)反应结束后乙瓶中的溶液需加足量H2O2溶液的目的是__________________________ (用化学方程式表示)。
(3)该黄铁矿石中硫元素的质量分数为_______________________(列出表达式即可)。
【实验二】测定铁元素的含量
(4)②中,若用铁粉作还原剂,则所测得的铁元素的含量______________ (填“偏大”、“偏小”或“无影响”)。
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有_________________。
(6)某同学一共进行了四次滴定实验,实验结果记录如下:
根据所给数据,计算该稀释液中Fe2+的物质的量浓度为c(Fe2+)=________________。
正确答案
(1)除去空气中的CO2,使装置乙中的溶液只吸收黄铁矿燃烧产生的SO2
提供反应物O2,排出装置中生成的SO2,使之完全被乙吸收。
(2)
(3)
(4)偏大
(5)250ml 容量瓶
(6)0.5000mol·L
解析
解析已在路上飞奔,马上就到!
知识点
27.工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2·6H2O),其过程为:
已知:
I.有关氢氧化物沉淀的pH:
Ⅱ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
(1)操作①需要加快反应速率,措施有充分搅拌和________(写一种)。
碳酸锶与盐酸反应的离子方程式__________________________。
(2)在步骤②~③的过程中,将溶液的pH由1调节至_____;宜用的试剂为_____。
A.1.5 B.3.7
C.9.7 D.氨水
E.氢氧化锶粉末 F.碳酸钠晶体
(3)操作③中所得滤渣的主要成分是_____。(填化学式)
(4)工业上用热风吹干六水氯化锶,适宜的温度是________。
A.50~60℃ B.80~100℃ C.100℃以上
(5)步骤⑥宜选用的无机洗涤剂是_____________。
正确答案
(1)加热、适当增加盐酸浓度。
SrCO3+2H+== Sr2+ +CO2↑+H2O
(2)B;E
(3)Fe(OH)3、BaSO4
(4)A;
(5)饱和氯化锶溶液
解析
解析已在路上飞奔,马上就到!
知识点
扫码查看完整答案与解析